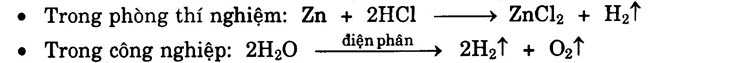| I. TÓM TẮT LÝ THUYẾT
– Điều chế khí hiđro:
Phản ứng thế: phản ứng hóa học giữa đơn chất và hợp chất thay thế nguyên tử của một nguyên tố khác trong hợp chất. – Cách thu khí H2: đẩy nước hoặc đẩy không khí. – Nhận biết khí H2: bằng que đóm đang cháy → ngọn lửa xanh. |
II. GIẢI BÀI TẬP SGK
Bài 1. Những phản ứng hóa học nào dưới đây có thể được dùng để điều chế hiđro trong phòng thí nghiệm?
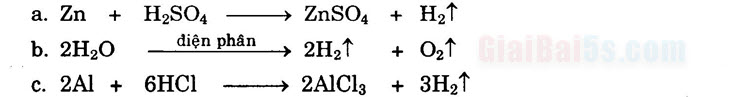
HƯỚNG DẪN GIẢI
Những phản ứng hóa học có thể được dùng để điều chế Hg trong phòng thí nghiệm là câu a, câu c.
Bài 2. Lập phương trình hóa học của các sơ đồ phản ứng cho sau đây và cho biết chúng thuộc loại phản ứng hóa học nào?
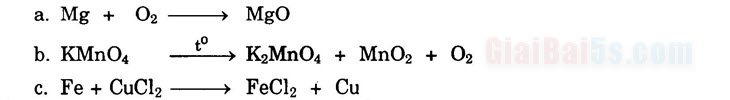
HƯỚNG DẪN GIẢI
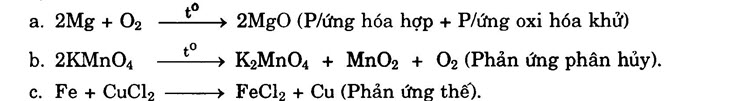 Bài 3. Khi thu khí oxi vào ống nghiệm bằng cách đây không khí, phải để vị trí ống nghiệm như thế nào? Vì sao? Đối với khí hidro, có làm thế được không? Vì sao?
Bài 3. Khi thu khí oxi vào ống nghiệm bằng cách đây không khí, phải để vị trí ống nghiệm như thế nào? Vì sao? Đối với khí hidro, có làm thế được không? Vì sao?
HƯỚNG DẪN GIẢI
– Phải để ống nghiệm thẳng đứng vì khí O2 nặng hơn không khí.
– Đối với khí H2 ta không làm thế mà phải úp thẳng đứng ống nghiệm và khí H2 nhẹ hơn không khí.
Bài 4*. Trong phòng thí nghiệm có các kim loại kẽm và sắt, dung dịch axit clohiđric HCl và axit sunfuric H2SO4 loãng:
a. Viết các phương trình hóa học có thể điều chế hiđro;
b. Phải dùng bao nhiêu gam kẽm, bao nhiêu gam sắt để điều chế được 2,24 lít khí hiđro (ở đktc)?
HƯỚNG DẪN GIẢI
a. Các PTHH có thể điều chế H2:
Zn + 2HCl → ZnCl2 + H2↑
Fe + H2SO4 (loãng) → FeSO4 + H2↑
Zn + H2SO4 → ZnSO4 + H2↑
Fe + 2HCl → FeCl2 + H2↑
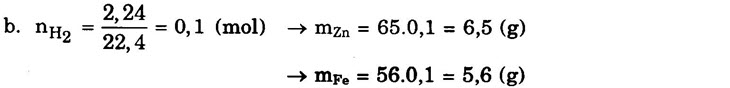
Bài 5. Cho 22,4 g sắt tác dụng với dung dịch loãng có chứa 24,5 g axit sunfuric.
a. Chất nào còn dư sau phản ứng và dư bao nhiêu gam?
b. Tính thể tích khí hiđro thu được ở đktc.
HƯỚNG DẪN GIẢI
PTHH: Fe + H2SO4 → FeSO4 + H2↑
1 mol 1 mol 1 mol 1 mol
0,4 mol 0,25 mol
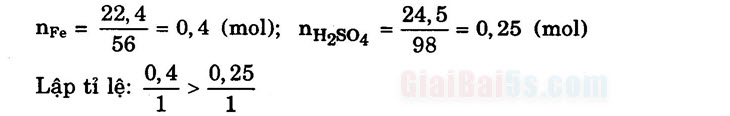
Vậy Fe dư.
a. nFe (pứ) = 0,25 (mol) → nFe (dư) =0,4 – 0,25 = 0,15 (mol)
mFe (dư) = 0,15.56 = 8,4 (g)
b. nH2= 0,25 (mol) → VH2 = 0,25 x 22,4 = 5,6 (l).
Nguồn website giaibai5s.com