| A. KIẾN THỨC CẦN NHỚ
Tính chất hóa học 1) Tính chất do nhóm chức –COOH gây nên: a) Tác dụng với kim loại (trước H): 2R(COOH)2 + 2Na → 2R(COONa)n + H2↑ b) Tác dụng với oxit bazơ: 2nRCOOH + M2On + 2(RCOO)nM + nH20 c) Tác dụng với bazơ: R(COOH)n + n NaOH → R(COONa)n + n H20 d) Tác dụng với muối của axit yếu: 2RCOOH + K2CO3 → 2RCOOK + CO2↑+H20 e) Tác dụng với rượu (phản ứng este hóa):
2) Phản ứng do gốc R gây nên: a) Nếu R là nguyên tử hiđro (axit fomic) dễ bị oxi hóa tương tự anđehit. +) Phản ứng tráng gương:
Chú ý: Hỗn hợp hai axit cho phản ứng tráng bạc, chứng tỏ sẽ có 1 chất là axit fomic. Nếu chất kia là đồng đẳng thì công thức phân tử có dạng: CnH2n+ 1COOH (n ≥ 1) +) Phản ứng với Cu(OH)2 (hoặc nước Fehling):
b) Nếu R là gốc hiđrocacbon no: cho phản ứng thế
c) Nếu R là gốc hiđrocacbon không no: +) Cộng với Ha, Bra (làm mất màu dung dịch Br)
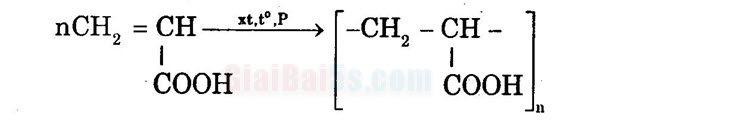
+) Trùng hợp:
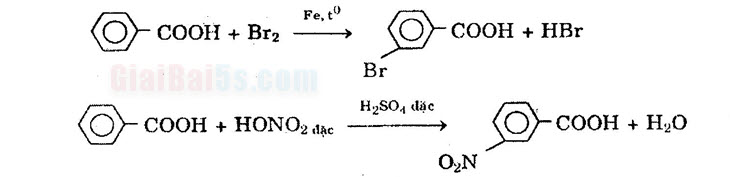
+) Oxi hóa không hoàn toàn: CH2=CH-COOH + H2O + [O] → CH2OH-CHOH-COOH d) Nếu R là gốc hiđrocacbon thơm: Do nhóm –COOH hút electron nên phản ứng thế vào nhân thơm xảy ra khó hơn so với benzen) và định hướng sản phẩm thế vào vị trí meta.
3) Phản ứng cháy:
|




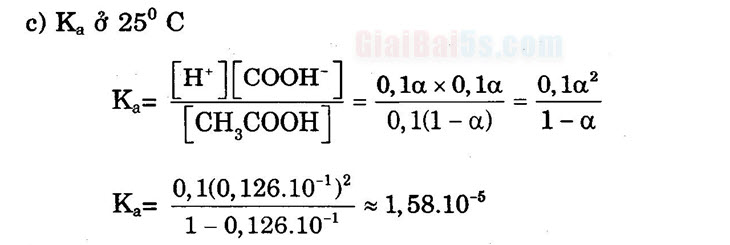
Nguồn website giaibai5s.com
- HƯỚNG DẪN GIẢI VÀ ĐÁP ÁN BÀI TẬP SGK TRANG 256 – 257
- Cấu trúc, phân lọai, danh pháp và tính chất vật lí Câu 1. Câu đúng: c.d;
Câu sai: a,b Câu 2.
- a) – Axit cacbonxylic là hợp chất hữu cơ mà phần tử có nhóm cacbonxyl (–COOH) liên kết trực tiếp với nguyên tử C hoặc nguyên tử H.
– Phân loại axit theo gốc hođrocacbon: +) Axit no đơn chức +) Axit không no đơn chức
+) Axit thơm b) Công thức cấu tạo chung dãy axit no CnH2n+ 1COOH
R – c
(với R: CnH2n+1) O-H
Công thức . Tên thông thường Tên quốc tế H-COOH Axit fomic
Axit metanoic. CH2-COOH Axit axetic
Axit etanoic CH2CH2COOH Axit propionic Axit propanoic CH3 (CH2)2-COOH Axit butilic
Axit butanoic CH(CH3)-COOH | Axit valeric
Axit pentaoic
Câu 3. . .
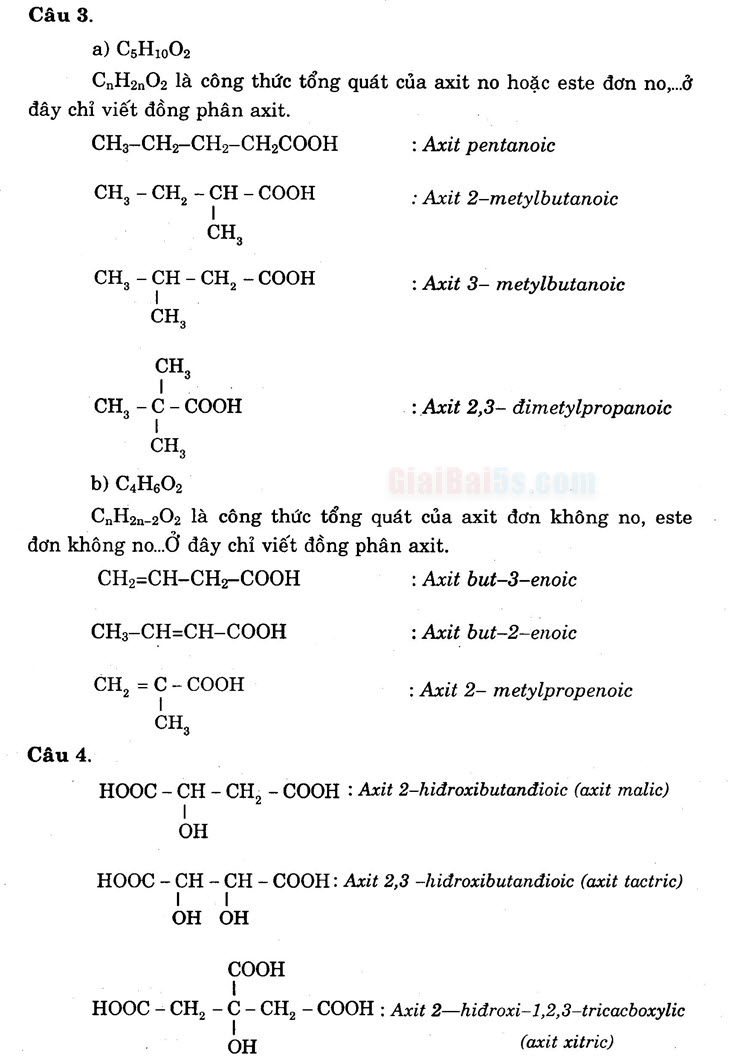
- a) C5H1002
CnH2nO2 là công thức tổng quát của axit no hoặc este đơn no, đây chỉ viết đồng phân axit.
CH3-CH2-CH2-CH2COOH : Axit pentanoic CH, -CH, -CH-COOH : Axit 2-metylbutanoic
: CH CH, – CH – CH, – COOH
: Axit 3– metylbutanoic
CH,
CH, -C-COOH
: Axit 2,3– đimetylpropanoic. CH, b) C4HO2
CnH2n-20, là công thức tổng quát của axit đơn không no, este . ! đơn không no. Ở đây chỉ viết đồng phân axit. CH2=CH-CH2-COOH
: Axit but-3-enoic
B
.
CH3-CH=CH-COOH
: Axit but-2-enoic
CH, = C-COOH
: Axit 2– metylpropenoic
CH,
Câu 4.
HOOC – CH – CH, – COOH: Axit 2 hiđroxibutanđioic (axit malic)
OH
HOOC – CH – CH – COOH: Axit 2,3 –hiđroxibutanđioic (axit tactric)
он он
COOH HOOC – CH2 -c-CH, -COOH: Axit 2_hidroxi-1,2,3-tricacboxylic OH
(axit xitric)
Axit trong quả nho: HOOC – CH – CH – COOH
. OH OH
COOH
Axit trong quả chanh: HOOC – CH2 -C – CH – COOH
OH
Axit trong quả táo: HOOC – CH – CH – COOH
.
OH
Câu 5. a)
00-
-H
.
>
> CH; 2-0 – H
—-
Các hiệu ứng trên thể hiện chất nào có liên kết 0 << H phân cực mạnh thì tách ra ion H+ dễ dàng nên lực axit lớn hơn.
- b) Nhiệt độ sôi, nhiệt độ nóng chảy của axit cao hơn và có khả năng tạo kiên kết hiđro liên phân tử bền vững hơn và sự phân cực của nhóm cacboxyl. .
- Tính chất hóa học, điều chế và ứng dụng Câu 1.
- a) Các phương trình phản ứng chứng minh axit axtic có đầy đủ tính chất của một axit.
CH3COOH + NaOH → CH3COONa + H2O 2CH3COOH + CaO + (CH3COO) Ca + H2O 2CH3COOH + 2Na → 2CH3COONa + H2T
2CH3COOH + CaCO3 + (CH2C00),Ca+ CO2T+ H2O b) Axit CH3COOH mạnh hơn H2CO3
2CH2COOH + Na2CO3 → 2CH.COONa + CO2T+ H20 Axit H2CO3 mạnh hơn phenol
O-ONa + CO2 + H20 – + NaHCO3 Câu 2. Câu đúng: a,c ;
Câu sai: b,d
Câu 3.
- a) CH2COOH < CICH,COOH < C1,CHCOOH < C1 CCOOH b) CH3CH2CH2COOH < CICH,CH2CH2COOH
< CH2CH(CI)CH2COOH < CH3CH2CH(CI)COOH Câu 4. Giải thích: HCl phân li hoàn toàn, nồng độ H+ lớn, tốc độ phản ứng lớn, H, thoát ra nhanh hơn CH,COOH phân li kém (K = 1,75.10^^), nồng độ | Ht nhỏ, tốc độ phản ứng nhỏ, sau một phút lượng H2 sinh ra ít hơn. Mg + 2HCl → MgCl2 + H27
(1) (mol) 1
0,5 Mg + 2CH3COOH → Mg(CH2C00)2 + H27 (2) (mol) 1
0,5 Vì số H2 thoát ra ở bình (A) và bình (B) lúc kết thúc phản ứng là bằng nhau nên sau 10 phút hai bóng cao su có thể tích bằng nhau. Câu 5.
- a) C&H ONa+ CH2=CH-COOH → CH2=CH-COONa + C&H OH b) NaHCO3 + CH2=CHCOOH → CH2=CH-COONa + CO2 + H20 c) CH2=CH-COOH + Ha N+CH3–CH2–COOH d) CH2=CH-COOH + Br2 → CH2Br-CHBr-COOH e) 2CH2=CH-COOH P,05 →(CH2=CH-CO)2O + H2O
anhidric acrylic Câu 6. a) CHỤCHO + HCNCH, -CH – CN .
OH CH, -CH-CN + 2H,0- ** ~CH, – CH – COOH + NH,
OH
он
–
—
C2H5Br + Mg – ete → C2H5MgBr C2HzMgBr + CO2 → C2H;COOMgBr
C2H COOMgBr + HCl → CH3COOH + MgClBr c) nCH2 = CH , xt, P +(-CH, – CH-). соон
COOH :
txt,
Câu 7. a) Nhận biết:
| C2H;OH HCHO CH3COCH3 CH3COOH Quỳ tím
| Hóa đỏ Na
H21 AgNO/NH3
Còn lại
.
b)
C6H5OH p-O2NC6H4CHO C6H-COOH Quỳ tím
Hóa đỏ AgNOM/NH | Còn lại | Ag Câu 8.
Ta có: nNaOH = 0,025 x 1 = 0,025 (mol) Phản ứng:
CH2COOH + NaOH → CHCOONa + H2O (mol) 0,025
0,025 0,025 x 60 x 100% C%.ch,COOH) =
= 3,75% Câu 9. a) Nồng độ mol dung dịch thu được:
mcH,COOH(nguyên chất) = 1,05 x 10,00 = 10,5 (gam)
40
10,5
nch.coon = 60° = 0,175 (mol)
0,175 126 = 0,1M.
.
–
H3COOH
CM(dd)CH,COOH = 1,75 = b) Độ điện li a
CH3COOH = H+ CH3COO Ban đầu: 0,1
0 0 Phản ứng: 0,10 0,10 0,1a … Cân bằng: 0,1(1-0) 0,10 0,10 pH = 2,9 = [H* ] = – 1g 10-2,9 = 0,126 x 10-2 [H* ] = 0,1 x a = a = 0,126.10-1.
- c) K, ở 25° C .. (
H COOH-] 0,1a x0,1a 0,1a? K= [CH.COOH] 0,11 –a) -a
K = 0,1(0,126.10-12
1 -0,126.10-1.
~1,58.10-5
(2): B;