| A. KIẾN THỨC CẦN NHỚ
I. Phân tích định tính nguyên tố Phân tích định tính nguyên tố là quá trình xác định thành phần các nguyên tố hóa học chứa trong một chất, bằng cách chuyển hóa các nguyên tố trong hợp chất hữu cơ thành các chất vô cơ đơn giản rồi nhận biết chúng bằng các phản ứng hóa học đặc trưng. 1) Xác định hiđro và cacbon: Oxi hóa hoàn toàn chất hữu cơ X bằng cách nung cùng với CuO để chuyển cacbon thành CO2, hiđro thành H2O. Dẫn hỗn hợp sản phẩm lần lượt qua: +) Bình (I) chứa CuSO4 khan (màu trắng), khi hút nước sẽ hóa thành CuSO4.5H2O (màu xanh lam) chứng tỏ mẫu X chứa nguyên tố hiđro. +) Bình (II) chứa dung dịch Ca(OH)2 hoặc Ba(OH)2 nếu hóa đục chứng tỏ có CO2 tức mẫu A có nguyên tố cacbon: CO2 + Ca(OH)2 → Ca CO3↓ + H2O CO2 + Ba(OH)2 → BaCO3↓ + H20 2) Xác định nitơ: a) Phương pháp xianua: Nung nóng chất hữu cơ X với Na trong ống nhiệm tạo phản ứng hóa hợp. Na + (C) + (N) + NaCN ( natri xianua) Cho NaCN tan trong nước, thêm vài giọt dung dịch FeSO phản ứng tạo dung dịch Na4[Fe(CN)6] màu vàng: FeSO4 + 2 NaCN → Fe(CN)2 + Na2SO4 Fe(CN)2 + 4NaCN → Na4[Fe(CN)6] Axít hóa dung dịch trên rồi thêm vài giọt FeCl3 sẽ thấy kết tủa xanh Prusse, chứng tỏ mẫu phân tích A có chứa nitơ: 3Na4[Fe(CN)6] + 4FeCl3 → Fe4[Fe(CN)6]3↓ + 12NaCl b) Phương pháp khác: – Đun mẫu phân tích (X) với H2SO4 đặc rồi với NaOH đặc, nếu có mùi khai của NH bay ra thì mẫu phân tích X có chứa nitơ. – Đốt mẫu phân tích trong không khí, ngửi có mùi khét (như tóc, móng, sừng cháy) thì mẫu phân tích có chứa nitơ. 3) Xác định oxi: Chưa tìm ra phương pháp định lượng trực tiếp, mà chỉ định lượng gián tiếp. II. Phân tích định lượng nguyên tố Phân tích định lượng nguyên tố là quá trình xác định khối lượng của mỗi nguyên tố hóa học chứa trong mẫu phân tích bằng cách chuyển các nguyên tố trong mẫu phân tích (chất hữu cơ) thành các chất vô cơ đơn giản, rồi định lượng chúng, từ đó suy ra khối lượng của mỗi nguyên tố có trong mẫu phân tích. 1) Định lượng cacbon và hiđro: Cân chính xác mẫu X đem phân tích đa gam), rồi oxi hóa hoàn toàn X bằng cách nung với CuO để chuyển cacbon thành CO2, hidro thành H2O. Dẫn hỗn hợp sản phẩm lần lượt qua: +) Bình (I) chứa một chất hút nước mạnh như: H2SO4 đặc, CaCl2 khan, P2O5 hoặc Mg(ClO4)2,… Độ tăng khối lượng bình (I) chính là khối lượng nước
Chú ý: Nếu phân tích sản phẩm có cả HCl, thì cần định lượng HCl để tính chính xác khối lượng H.
+) Bình (II) chứa bazơ hoặc oxit bazơ để hấp thụ CO,. Độ tăng khối lượng bình(II) chính là khối lượng CO2
Chú ý: Nếu phân tích sản phẩm có cả khí có thì cần định tượng co để | tính chính xác khối lượng cacbon.
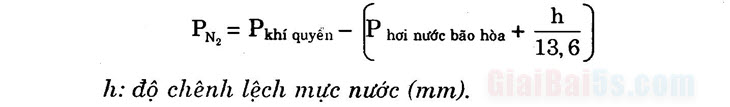
2) Định lượng nitơ: a) Phương pháp Đuyma: chuyển nitơ trong mẫu phân tích thành khí N2, đo thể tích N2 ⇒ mN. Áp dụng: Nung chất hữu cơ có chứa N với CuO trong khí quyển CO2, sản phẩm cho qua lưới đồng nung nóng rồi dẫn vào bình chứa KOH đặc để chỉ cho khí N2 thoát ra vào một nitơ kế. Biết thể tích Ng ở nhiệt độ và áp suất xác định sẽ tính được mN. Chú ý: Tính áp suất khí Ng trong ống nghiệm úp trên chậu nước.
b) Phương pháp Kjeldah (Kiên-đan): chuyển nitơ trong hợp chất hữu cơ về dạng NH3 định phân NH3, suy ra mN. Áp dụng: Đun chất hữu cơ có chứa nitơ với H2SO4 để chuyển thành dạng NH3 và sau đó là (NH4)2SO4:
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH3↑ + 2H20 Định phân NH3 thoát ra bằng dung dịch H2SO4 chuẩn, rồi NaOH chuẩn, suy ra số mol NH3 và mN.
|
B. HƯỚNG DẪN GIẢI VÀ ĐÁP ÁN BÀI TẬP SGK TRANG 113 – 114

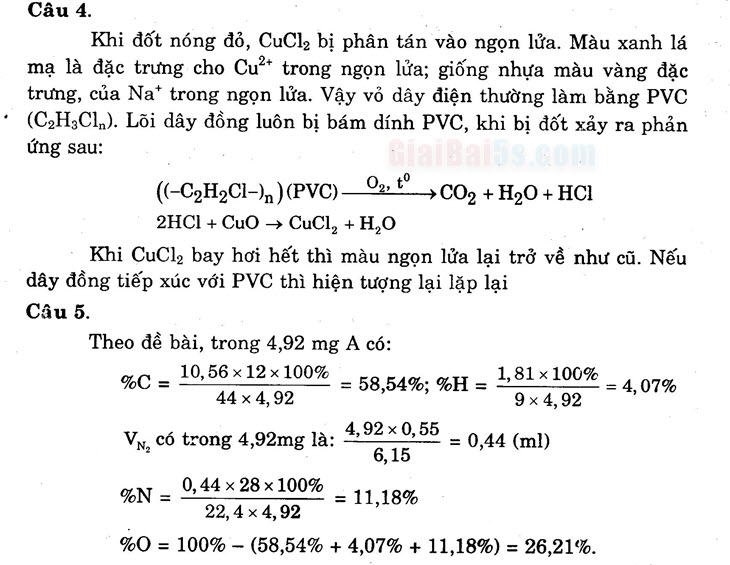
Nguồn website giaibai5s.com
Câu 1.
Phân tích định lượng cần xác định hàm lượng của C, H qua định lượng CO2 và H2O GIẢI BÀI TẬP HÓA HỌC 11 – NÂNG CAO
+) Giống nhau: đều chuyển hợp chất hữu cơ thành hợp chất vô cơ đơn giản.
+) Khác nhau:
– Phân tích định tính cần xác định sự có mặt của C, H qua sản phẩm CO2 và H2O.
– Phân tích định lượng cần xác định hàm lượng của C, H qua sản phẩm CO2 và H2O. Câu 2.
- a) Nhận biết H2O bằng cách hơ tấm kính hoặc đáy bình cầu đựng nước lên phía trên ngọn lửa đốt chất hữu cơ thấy có hơi nước ngưng tụ.
Sục khí thu được khi đốt hợp chất hữu cơ vào dung dịch Ba(OH)2 thấy có kết tủa trắng:
Ba(OH)2 + CO2 – > BaCO3+ + 2H20. | b) Nhận biết halogen trong hợp chất hữu cơ bằng cách sau: Lấy 1 đoạn dây đồng, đốt nóng trên ngọn lửa đèn cồn đến khi ngọn lửa không còn nhuốm màu xanh lá mạ thì nhúng đoạn dây đồng vào chất hữu cơ dạng lỏng hoặc cho tiếp xúc với chất hữu cơ dạng rắn. Lại đưa đoạn dây đồng lên ngọn lửa đèn cồn còn lại xuất hiện ngọn lửa màu xanh lá mạ chứng tỏ có halogen.
+) Giải thích: Ban đầu Cu + O2 + CuO (màu xanh lá mạ) , Khi Cu bị bao phủ lớp CuO màu ngọn lửa mất. Hợp chất hữu cơ tỳCO2 + H2O + HCl…
2HCl + CuO → Cucl, +H,0
2Cu + 0, + 2CuO (màu xanh lá mạ) c) Định lượng H2O, CO, – Hấp thụ H2O; dùng P2O5 hoặc H2SO4
– Hấp thụ CO2: dùng KOH rắn hoặc dung dịch kiềm lấy dư Câu 3.
- a) Nhận biết NHA: Khí có mùi khai, làm xanh quỳ tícn tẩm ướt. Đáp án: C. b) Đáp án: D.
Câu 4.
Khi đốt nóng đỏ, CuCl2 bị phân tán vào ngọn lửa. Màu xanh lá mạ là đặc trưng cho Cuot trong ngọn lửa; giống nhựa màu vàng đặc trưng, của Nat trong ngọn lửa. Vậy vỏ dây điện thường làm bằng PVC (C2H4Cla). Lõi dây đồng luôn bị bám dính PVC, khi bị đốt xảy ra phản | ứng sau:
(1-C2H2C1–)n)(PVC) — 0,, to>CO2 + H2O + HCI
2HCI + CuO → CuCl, +H2O • Khi CuCl2 bay hơi hết thì màu ngọn lửa lại trở về như cũ. Nếu dây đồng tiếp xúc với PVC thì hiện tượng lại lặp lại Câu 5. Theo đề bài, trong 4,92 mg A có: 10,56 x 12 x 100%
1,81 x 100% = 58,54%; 9
– = 4,07% 44 x 4,92
9 x 4,92 v, có trong 4,92mg là: 1,94*0,= 0,44 (ml)
6,15 0,44 x 28 x 100%
= 11,18% 22,4×4,92 %0 = 100% – (58,54% + 4,07% + 11,18%) = 26,21%.

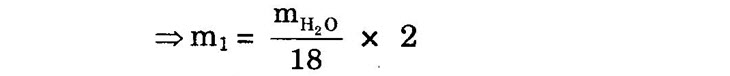
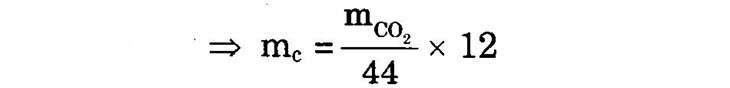
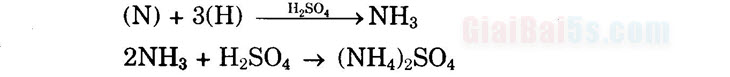 Sau đó thêm NaOH đặc cho đến dự và đun nhẹ để đuổi NH ra khỏi muối amoni sunfat.
Sau đó thêm NaOH đặc cho đến dự và đun nhẹ để đuổi NH ra khỏi muối amoni sunfat.