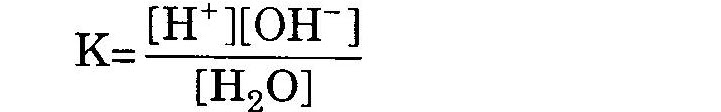| A. KIẾN THỨC CẦN NHỚ .
1. Tích số ion của nước
KH2O = K[H2O] = [H+][OH‾] = 10-14 (*) 2. Ý nghĩa tích số ion của nước – Môi trường axit: [H+]> 10-7 M – Môi trường trung tính: [H+] = 10-7 M – Môi trường kiềm: [H+] < 10-7 M. 3. Khái niệm về pH: Nồng độ ion [H+] = 10-a mol/l thì a là trị số pH của dung dịch. Công thức tính pH và KOH: pH = -lg[H+]; pOH= -lg[OH‾] Với dung dịch axit: [H+] > 10-7 ⇒ pH < 7. Với dung dịch kiềm: [H+] < 10-7 ⇒ pH > 7. pH + pOH = 14. 4. Chất chỉ thị axit bazơ
Chú ý: Có thể trộn lẫn một số chất chỉ thị có khoảng pH đổi màu kế tiếp nhau, ta được hỗn hợp chất chỉ thị – bazơ vạn năng. |
B. HƯỚNG DẪN GIẢI VÀ ĐÁP ÁN BÀI TẬP SGK TRANG 20



Nguồn website giaibai5s.com
Câu 1. – Môi trường axit là môi trường trong đó:
[H* ] > [OH-] hay (H* ] > 10-7M → pH <7 – Môi trường trung tính là môi trường trong đó:
[H+ ] = [OH-] = 10-7M → pH = 7 – Môi trường kiềm là môi trường trong đó:
[H+]< [OH] hay [H+] < 10-7 M + pH > 7. Câu 2. Đáp án: A.
[OH-] = 2,5.10-10 MTM pOH = 10 – 0,398 = 9,602 =pH = 14 – 9,602 = 4,398 3 Môi trường axit.
Câu 3. Đáp án: A. Câu 4. Đáp án: D. Câu 5. Đáp án: C. Câu 6. Đáp án: B. Câu 7. . Vì [HẤJHNO, > [H*CH,COOH chứng tỏ số phân tử HNO3 phân li thành ion nhiều hơn số phân tử của CH3COOH nên độ điện li:
AHNO, > ACH,COOH :
Câu 8.
– Chất chỉ thị màu axit-bazơ là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch.
– Màu của quì tím và phenolphtalein trong các môi trường: – Môi trường
Axit Trung tính Kiềm Chất chỉ thị
Quỳ (tím)
Đó
Tím
xanh
Phenolphtalein
Không màu |
Không màu | Hồng (đỏ, tím)
(Không màu)
Câu 9.
Ta có: pH = 10 =[H+= 10-10
:
10-14
…
>> JOH
– = 10-45 [NaOH] = 10-4 M.
= 10-4
10-10
Và nNaOH = CM x V = 0,3.10-* (mol)
mnach = 0,3.10-4 x 40 = 12.10-4 (gam)
Vậy cần 12. 10* (gam) NaOH để pha được 300 ml NaOH có pH = 10. Câu 10. a) Ta có: nHCl = 3 = 0,04 (mol) = CMHC) = 9 0,1M
0,4 Phản ứng: HCl + H+ + Cl-.
0,1M 0,1M 0,1M Suy ra: [H+] = [HCM] = 0,1M =10-‘M + pH = -1g10-1 = 1
1.46
0,04
(1)
- b) Ta có: nHCl = 0,1 x 1 = 0,1 (mol) và nNaOH = 0,4 x 0,375 = 0,15 (mol) Phản ứng: HCl + NaOH + NaCl + H2O
(2) (mol) 0,1 0,1 0,1 Từ (2) => nNaOH phản ứng= 0,1 (mol) = nNaOH dư = 0,15 – 0,1 = 0,05 (mol)
CMNaOH sau phản ứng) = = 0,1M = [OH-] = [NaOH) = 0,1 = 10-2 M
[H+] = 10 = 10-8 = pH = – 1g10-18 = 13.