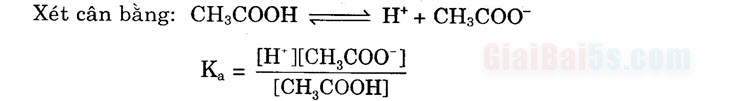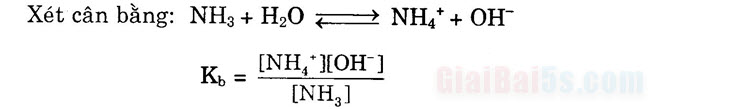| A. KIẾN THỨC CẦN NHỚ
1. Axit và bazơ theo thuyết A-rê-ni-ut Axit là chất khi tan trong nước phân li ra cation H+ Bazơ là chất khi tan trong nước phân li ra anion OH‾ 2. Axit nhiều nấc: là những axit mà một phần tử phân li nhiều nấc ra ion H+. 3. Bazơ nhiều nấc: là những bazơ mà một phân tử phân li nhiều nấc ra ion OH‾. 4. Hiđroxit lưỡng tính: là những chất khi tan trong nước vừa có thể phân li như axit, vừa có thể phân li như bazơ. 5. Khái niệm về axit và bazơ theo thuyết bron-stết Axit là chất nhường proton (H+). Bazơ là chất nhận proton. 6. Hằng số phân li axit Ka là hằng số phân li axit. Đối với axit xác định, K, chỉ phụ thuộc vào nhiệt độ. Giá trị Ka của axit càng nhỏ, lực axit của nó càng yếu. 7. Hằng số phân li bazơ
8. Muối: Muối là hợp chất, khi tan trong nước phân li ra cation kim loại (hoặc cation NH4) và anion gốc axit, Muối có hai loại: muối . trung hòa và muối axit. |
B. HƯỚNG DẪN GIẢI VÀ ĐÁP ÁN BÀI TẬP SGK TRANG 16



Nguồn website giaibai5s.com
Câu 1.
Phát biểu định nghĩa axit-bazơ a) Theo quan điểm của thuyết A-rê-ni-ut: • Axit là chất tan trong nước phân li ra cationH+
HCl + H+ + Cl. • Bazơ là chất tan trong nước phân li ra anion OH
KOH → K* + OH-. b) Theo quan điểm thuyết tron-stết:
- Axit là chất nhường proton (H*) , • Bazơ là chất nhận proton
Axit P Bazơ + H+ CH3COOH + H20 F CH:C00+ H30+
NH3 + H20 NH + OHCâu 2.
– Axit một nấc: (đơn axit) là mỗi phân tử axit phân li một nấc ra ion H+. HCl + H+ + C1
– Axit nhiều nấc: (đa axit) là mỗi phân tử axit phân li nhiều nấc ra ion H+.
H2SO4 → H+ + HSOZ
HSO; A H+ + so- Bazơ một nấc: (đơn bazơ) là mỗi phân tử bazơ chỉ phân li một nấc ra ion OH
NaOH → Nat + OH- Bazơ nhiều nấc: (đa bazơ) là một phân tử phân li nhiều nấc ra ion OH
Ca(OH)2 + Ca(OH)* + OH
Ca(OH) A Ca2+ + OHR – Hiđroxit lưỡng tính: • Theo A-rê-ni-ut: hiđroxit lưỡng tính khi tan trong nước vừa có thể phân li như axit vừa có thể phân li như bazơ:
| Zn(OH)2 + Zn2+ + 2OH” (kiểu bazơ)
Zn(OH)2 + 2H+ + ZnO3 (kiểu axit) • Theo Bron-stết: Hiđroxit lưỡng tính có khả năng vừa cho
hoặc nhận proton:
Zn(OH)2 + 2H+ + Zn2+ + 2H20 (tính bazo).
Zn(OH)2 + 2OH- + ZnO + 2HẠO (tính axit) – Muối: • Muối trung hòa: Là muối trong phân tử anion gốc axit
không còn nguyên tử hiđro. Ví dụ: Na2CO3, CuSO4, (NH4)2SO4. • Muối axit: là muối trong phân tử anion gốc axit còn
hidro. Ví dụ: NaHCO3, Na2HPO4, NH4HSO4 Câu 3.
Hằng số phận li +) Hằng số phân li axit là Ka để biểu thị đặc trưng độ mạnh của axit:
HA A H* + A
ū
[H+][A]
[HA]
Ví dụ: CH2COOH ; CHẠCOO- + H+
w [CH,C00-[H*]
Ka = TCH,COOH)
_
+) Hằng số phân li bazơ là K, để biểu thị độ mạnh yếu của bazơ.
A + H20 F HA + OHK. – [HA][OH ] (nước được coi là hằng số)
[A-] Ví dụ: NH3 + HOH + NH + OH
Ky = [NH]](OHS
(NH3] Câu 4. Đáp án: C. Câu 5. Đáp án: B. Câu 6. Đáp án: C. Câu 7. Phương trình điện li của các chất trong dung dịch:
K2CO3 + 2K+ + CoNaClO → Nat + C10 Na2S → 2Na+ + S2Na2HPO4 + 2Na+ + HPOHPOS + H+ + PO NaHS → Na* + HSHS – H + 52Na3PO4 + 3Na+ + POSSn(OH)2 + Sn2+ + 2OH
H„SnO, P 2H* + Sno Câu 8. +) Phân tử hay ion có tính axit:
HI: HI + H,0 A H30* + I +) Phân tử hay ion bazơ: CH3COO : CH3C00- + H20 A CH3COOH + OH
=
POS : PO + H20 F HPO + OH NH3 : NH3 + H20 NH + OH
S2: S2 + H20 F HS + OH +) Ion lưỡng tính:
H2PO4 : H2PO4 + H20 A H3PO4 + OH H2PO4 + H20
F HPO + H2O* HPO : HPO + H20 5 HPO4 + OH
HPO + H20 F PO + H30* . Câu 9. +) HF + H20 F H30* + F
= 1H30 [H3O+][F]
(HF]
(HCIO][OH] +) C10 + H20 A HCIO + OH
[C10 ] +) NH; + H2O + NH + Hạo 4K = INH, J[H, 1
[NH] +) F + H20 F HF + OH
_ (HF][OH-].
[F-) Câu 10.
- a) Phan ứng: CH3COOH + CH Coor + H+; K = 1,75.10-5 Ban đầu: 0,1 Cân bằng: 0,1-x (HI
X.X != 1,75.10-5 h
= 1,75.10-5 [CH2COOH]
0,1-X x << 0,1 (vì CH3COOH là axit yếu).
x = 1,75.10-5.0,1 = x = 1,32.10-3 (M). b) Phản ứng: NH3 + H2O + NH + OHBan đầu: 0,1 Cân bằng: 0,1-x
K C. [NH ][OH =
= 1.80.10-5 hay ^^_=1,80.10° (NH3]
0,1-X Vì x < 0,1 (vì NH là bazơ yếu)
oxo = 1,8.10-4.0,1 = x = 1,34. 10-3 (M)