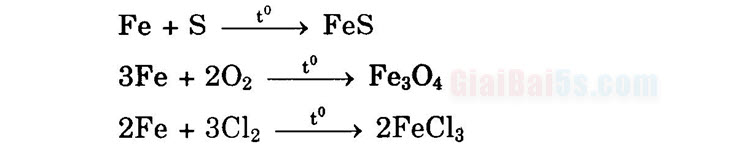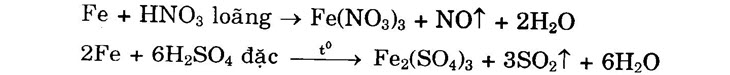| A. KIẾN THỨC CẦN NHỚ
I. Tính chất hóa học 1. Tác dụng với phi kim
2. Tác dụng với axit a) Với dung dịch HCl, H2SO4 loãng Fe + H2SO4 → FeSO4 + H2↑ b) Với dung dịch HNO3 và H2SO4 đặc, nóng
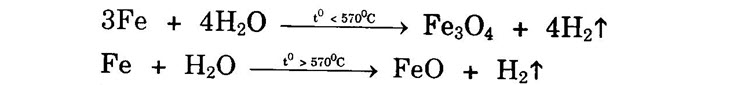
Chú ý: Fe bị thụ động với axit HNO4 đặc, nguội và H2SO4 đặc, nguội. 3. Tác dụng với dung dịch muối Fe + CuSO4 → FeSO4 + Cu↓ 4. Tác dụng với nước
Quặng sắt quan trọng là: quặng manhetit (Fe3O4) (hiếm có trong tự nhiên), quặng hemantit (Fe2O3), quặng xiuerit (FeCO3) và quặng pirit (FeS2). |



Nguồn website giaibai5s.com
- HƯỚNG DẪN GIẢI VÀ ĐÁP ÁN BÀI TẬP SGK TRANG 198 Câu 1.
- a) Vị trí của sắt trong bảng hệ thống tuần hoàn: Sắt là nguyên tố kim loại chuyển tiếp, thuộc nhóm VIIIB, chu kỳ 4, số hiệu nguyên tử là 26. b) Cấu hình electron của nguyên tử và ion sắt:
Fe: 1s22s22p°3s23p°3d4s” viết gọn [Ar]3d4s?
Fet: [Ar]3d và Fe3+: [Ar]3d c) Tính chất hóa học cơ bản của sắt: + Tác dụng với phi kim:
Fe + S + → FeS 3Fe + 202_Fe304
2Fe + 3Cl2_2FeCl3 + Tác dụng với axit: • Với dung dịch HCl, H2SO4 loãng:
Fe + H2SO4 → FeSO4 + H2T • Với dung dịch HNO3 và H2SO4 đặc, nóng:
Fe + HNO3 loãng → Fe(NO3)3 + NOT + 2H,0
2Fe + 6H2SO4 đặc → Fe2(SO4)3 + 3SO,1 + 6H2O Chú ý: Fe bị thụ động với axit HNO3 đặc, nguội và H2SO4 đặc, nguội. . + Tác dụng với dung dịch muối:
Fe + CuSO4 → FeSO4 + Cut
+ Tác dụng với nước:
3Fe + 4H20 _° < 570°C Fe3O4 + 4H27
Fe + H20 __° > 570°C → FeO + H27 Câu 2. Gồm các trường hợp sau: • Trường hợp 1: Oxi đủ hoặc dư, sắt phản ứng hết tạo ra oxit
Fe3O4 hoặc Fe2O3. Các oxit này tác dụng với dung dịch axit HCl theo phản ứng: Fe2O3 + 6HCI → 2FeCl3 + 3H20
(1) Fe3O4 + 8HC1 — 2FeCl2 + FeCl2 + 4H20 (2) • Trường hợp 2: Oxi phản ứng hết, sắt dư, tạo thành các oxit
sắt. Khi cho các sản phẩm này vào dung dịch HCl thì có phản ứng:
Fedu + 2HCl → FeCl2 + H2T. Phản ứng của oxit sắt với axit HCl như các phản ứng (1) và (2). Nếu axit hết, Fe chưa phản ứng hết, thì có phản ứng sau:
Fe + 2FeCl3 + 3FeCl2 Câu 3.
Có thể chọn hai thuốc thử là axit HCl và dung dịch kiềm NaOH. Trình bày: . – Lấy vào mỗi ống nghiệm một ít bột kim loại đã cho.
– Nhỏ vào mỗi ống nghiệm một ít dung dịch axit HCl. Ở ống nghiệm nào không có hiện tượng gì xảy ra thì đó là ống đựng kim loại Ag. Phản ứng xảy ra ở các ống nghiệm còn lại là:
2Al + 6HCl → 2AlCl3 + 3H21 Fe + 2HCl -> FeCl2 + H21
Mg + 2HCl → MgCl2 + H21 Nhỏ từ từ dung dịch kiềm vào ống nghiệm chứa các dung dịch muối vừa thu được. Ở ống nào thấy có kết tủa tạo thành rồi lại tan ra thì đó là ống nghiệm chứa muối nhôm, nhờ vậy ta nhận ra kim loại nhôm:
AlCl3 + 3NaOH + 3NaCl + Al(OH)3 : Al(OH)+ NaOH → Na[Al(OH)4] Ở ống nghiệm nào thấy xuất hiện kết tủa màu trắng xanh, sau đó dần dần hóa nâu đỏ thì ống nghiệm đó chứa dung dịch muối sắt (II), nhờ đó nhận ra kim loại Fe:
FeCl2 + 2NaOH → Fe(OH)2+ + 2NaCl
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)36
(2)
.
.
Ở ống nghiệm nào thấy xuất hiện kết tủa màu trắng không bị biến đổi thì đó là ống nghiệm chứa dung dịch muối magie, nhờ đó nhận được kim loại Mg:
MgCl2 + 2NaOH → Mg(OH)2+ + 2Nači Câu 4. Phản ứng: Mg + CuSO4 + MgSO4 + Cu
Fe + CuSO4 → FeSO4 + Cu Theo đề bài, ta có: nMg = 0,01 (mol) và nFe = 0,02 (mol). Từ (1) và (2), nếu Mg và Fe phản ứng hết thì thu được 0,03 mol Cu. Khối lượng kim loại thu được sau phản ứng là:
0,03 x 64 = 1,92 (gam). Thực tế chỉ thu được 1,88 gam kim loại. Chứng tỏ kim loại đã cho không phản ứng hết, Mg có tính khử mạnh hơn Fe nên phản ứng trước. Lượng Cu sinh ra ở (1) là 0,01 mol = tương ứng với khối lượng 0,64 gam. Khối lượng Fe dư và Cu sinh ra ở (2) là: 1,88 – 0,64 = 1,24 (gam). Gọi số mol Fe tham gia phản ứng là a mol, khối lượng sắt dư là (1,12 – 56a) và khối lượng Cu sinh ra ở (2) là 64a. Ta có phương trình đại số sau:
(1,12 – 56a) + 64a = 1,24 > a = 0,015 (mol). Luợng CuSO4 trong 250 ml dung dịch đã phản ứng hết là:
0,015 + 0,01 = 0,025 (mol). Nồng độ mol/l của dung dịch CuSO, đã dùng là: CM =
0,025
| = 0,1M. Câu 5.
0.25
.-..—-…-.
.
250
Suy ra: CM = ,02 = 0,464M.
0,5 b) Cho dần dần mạt sắt vào dung dịch trên đến dư thì: – Xuất hiện kim loại màu đỏ. Màu xanh của dung dịch CuSO, bị nhạt dần. – Phương trình phân tử: CuSO4 + Fe + FeSO4 + Cul – Phương trình ion: Cuot + Fe + Fe** + Cu – Ion Cut là chất oxi hóa, Fe là chất khử. Khối lượng kim loại sau phản ứng tăng:
(64 – 56) x 0,232 = 1,856 (gam).