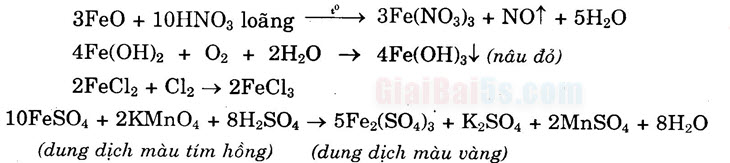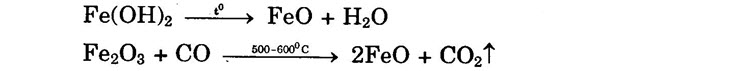| A. KIẾN THỨC CẦN NHỚ
I. Hợp chất sắt (II) 1. Tính chất hóa học của hợp chất sắt (II) . a) Hợp chất sắt (II) có tính khử:
b) Oxit và hiđroxit sắt (II) có tính bazơ: tác dụng với axit HCl, H2SO4 loãng tạo muối sắt (II). 2. Điều chế một số hợp chất sắt (II)
Fe2+ + 2OH– → Fe(OH)2↓ (trắng xanh) Fe + 2HCl + FeCl2 + H2↑ FeO + H2SO4 → FeSO4 + H2O II. Hợp chất sắt (III) 1. Tính chất hóa học của hợp chất sắt (III) a) Hợp chất sắt (III) có tính oxi hóa: Fe + 2FeCl3 → 3FeCl2 Cu + 2FeCl3 (vàng nâu) → CuCl2 (màu xanh) + FeCl2 2FeCl3 + 2KI → 2FeCl2 + 2KCl + I2 b) Oxit và hiđroxit sắt (III): tác dụng với axit tạo muối sắt (III). 2. Điều chế một số hợp chất sắt (III)
– Cho dung dịch kiềm tác dụng với dung dịch muối sắt (III). FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl – Fe(OH)3 không tan trong nước nhưng dễ tan trong dung dịch axit. 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H20 – Sắt (III) oxit là oxit bazơ nên dễ tan trong các dung dịch axit mạnh. |


Nguồn website giaibai5s.com
- HƯỚNG DẪN GIẢI VÀ ĐÁP ÁN BÀI TẬP SGK TRANG 202 Câu 1.
- a) Tính chất hóa học đặc trưng của hợp chất sắt (II) là tính khử, | tuy nhiên FeO vừa có tính oxi hóa và có tính khử:
3FeO + 10HNO3 loãngť → 3Fe(NO3)3 + NOT + 5H20 FeO + H2 → Fe + H2O 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3+ (nâu đỏ)
. 2FeCl2 + Cl2 → 2FeCl3 10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4
+ 8H2O b) Tính chất hóa học chung của hợp chất sắt (III) là tính oxi hóa:
Fe + 2FeCl3 + 3FeCl2 Cu + 2FeCl3 + 2FeCl2 + CuCl2
2FeCl3 + 2KI → 2FeCl2 + 2KCl + 12 Câu 2.
- a) Các oxit sắt là oxit bazơ do tác dụng với axit (HCl, H2SO4 loãng) tạo thành muối sắt (II) và sắt (III) tương ứng.
FeO + H2SO4 → FeSO4 + H2O
Fe2O3 + 6HCl + + 2FeCl3 + 3H20 b) Các hiđroxit sắt là bazơ do tác dụng với axit tạo thành muối sắt (II) và sắt (III) tương ứng.
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H20
Fe(OH)2 + 2HCl → FeCl2 + 2H20 Câu 3. Phản ứng:
Fe + H20 ___°3570°C → FeO + H2 FeO + 2HCl → FeCl2 + H2O 2FeCl2 + Cl2 → 2FeCl3 FeCl3 + 3NaOH → Fe(OH)3+ + 3NaCl 2Fe + 6H2SO4 -> Fe2(SO4)3 + 3S027 + 6H20 Fe2(SO4)3 + Fe + 3FeSO4 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH), 3Fe + 20, _to; Fe3O4 Fe3O4 + 4H2 + 3Fe + 4H20
Fe + 4HNO3 → Fe(NO3)3 + NOT + 2H20
Câu 4. a) Phương trình ion rút gọn:
MnO2 + 5Fe2+ + 8H* → Mn2+ + 5Fe3+ + 4H20 n = Fe2+ là chất khử, MnO, là chất oxi hóa.
- b) Theo phản ứng trên thì cứ 5 mol Fe + phản ứng với 1 mol MnO4. c) Số mol MnO4 có trong 25 cmo dung dịch KMnO4 0,03M là:
0,03 x 0,025 = 0,00075 (mol). Số mol Fe phản ứng hết với lượng KMnO4 ở trên là:
0,00075 x 5 = 0,00375 (mol). | d) Nồng độ mol/l của dung dịch thuốc tím ban đầu là:
0,00375 -0.1875M.
0,02 Khối lượng ion Fe2+ trong 200 cmo dung dịch ban đầu là:
0,1875 x 0,2 x 56 = 2,1 (gam). e) Phần trăm khối lượng FeSO4 là: 0,1875 * 0,2 x 152
10
.
* 100% = 57%.