| A. KIẾN THỨC CẦN NHỚ
I. Hợp chất crom (II) 1. Crom (II) oxit – CrO – CHO là oxit bazơ, tác dụng với axit. CrO + 2HCl → CrCl2 + H20 – Cro có tính khử, dễ bị oxi hóa thành Cr2O3. 2. Crom (II) hiđroxit – Cr(OH)2 – Điều chế: CrCl2 + 2NaOH → Cr(OH)2↓+ 2NaCl – Cr(OH)2 có tính khử: 4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3 – Cr(OH)2 là một bazơ: Cr(OH)2 + 2HCl → CrCl2 + 2H2O 3. Muối crom (II): có tính khử mạnh. 2CrCl2 + Cl2 → 2CrCl3 II. Hợp chất crom (III) 1. Crom (III) oxit – CrO3: là oxit lưỡng tính. 2. Crom (III) hiđroxit – Cr(OH)3 . – Điều chế: CrCl3 + 3NaOH → Cr(OH)3↓ + 3NaCl – Cr(OH)3 là hiđroxit lưỡng tính. Cr(OH)3 + 3HCl → CrCl3 + 3H20 Cr(OH)3 + NaOH → Na[Cr(OH)4] hay NaCrO2.2H20 natri cromit 3. Muối crom (III): có tính oxi hóa và tính khử. 2Cr3+ + Zn → 2Cr2+ + Zn2+ 2Cr3+ + 3Br2 + 16OH‾ → 2CrO42- + 6Br‾ + 8H20 III. Hợp chất crom (VI) 1. Crom (VI) oxit – CrO3 – Crom (VI) oxit (CrO3) là chất rắn màu đỏ thẫm. – CrO3 là một oxit axit, tác dụng với nước tạo ra axit: CrO3 + H2O → H2CrO4 : axit cromic 2CrO3 + H2O → H2Cr2O7 : axit đicromic – CrO3 có tính oxi hóa mạnh. 2CrO3 + 2NH3 → Cr2O3 + N2↑ + 3H20 2. Muối cromat và đicromat – Muối cromat có màu vàng của ion cromat CrO42-. – Muối địcromat có màu da cam của ion đicromat Cr2O72- . – Các muối cromat và đicromat có tính oxi hóa mạnh.
– Trong dung dịch ta có cân bằng:
|


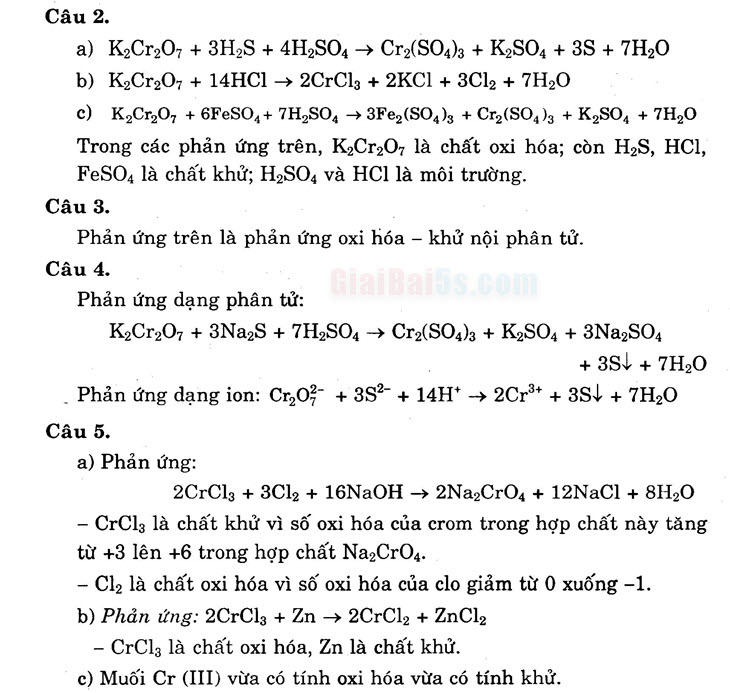
Nguồn website giaibai5s.com
- HƯỚNG DẪN GIẢI VÀ ĐÁP ÁN BÀI TẬP SGK TRANG 194 Câu 1.
- a) Nhận xét về tính chất hóa học của các hợp chất crom (II): B. (1) Hợp chất crom (II) có tính khử:
4CrO + O2 + 2Cr2O3 4Cr(OH)2 + O2 + 2H20 + 4Cr(OH)2 4CrCl2 + 4HCl + O2 + 4CrCl3 + 2H,0
(2) Hợp chất CuO và Cr(OH)2 có tính bazơ:
CrO + 2HCl → CrCl2 + H2O
. Cr(OH)2 + 2HCl → CrCl2 + 2H,0. b) Nhận xét về tính chất hóa học của các hợp chất crom (III): (1) Hợp chất crom (III) oxit và crom (III) hiđroxit có tính lưỡng tính:
Cr2O3 + 6HCl → 2CrCl2 + H2O Cr2O3 + 2NaOH + 3H20 → 2Na[Cr(OH)4] Cr(OH)3 + 3HCl → CrCl3 + 3H20
Cr(OH)2 + NaOH → Na[Cr(OH)4] hay NaCrO2.2H2O (2) Hợp chất crom (III) vừa có tính khử, vừa có tính oxi hóa: – Trong môi trường axit, Zn khử muối Cr(III) thành muối Cr(II).
2CrCl3 + Zn → 2CrCl2 + ZnCl2 – Trong môi trường kiềm, Bry oxi hóa muối CrIII) thành muối CRVI). . 2NaCrO2 + 3Br2 + 8NaOH → 2Na,CrO4 + 6NaBr + 4H20 c) Nhận xét về tính chất hóa học của hợp chất crom (VI): (1) Crom (VI) oxit CrO4 có tính oxi hóa rất mạnh và là một oxit axit.
2CrO3 + 2NH2 + Cr2O3 + N2 + 3H20 4CrO3 + C2H5OH + 6H2SO4 → 2Cr2(SO4)3 + 2C027 + 9H20
CrO3 + H2O + H2CrO4
2CrO3 + H2O + H2Cr2O7 Hai axit H2CrO4 và H2Cr2O không bền, chỉ tồn tại trong dung dịch. Nếu tách khỏi dung dịch chúng phân hủy trở lại thành CrO3.
(2) Muối cromat và đicromat. – Muối cromat và đicromat đều là những chất oxi hóa rất mạnh, nhất là trong môi trường axit và cho (tạo) sản phẩm khử là Cr3+. K,Cr207 + 6KI + 7H2SO4 → Cr2(SO4)3 + 4K2SO4 + 312 + 7H2O
K2Cr2O7 + 3SO2 + H2SO4 → Cr2(SO4)3 + K2SO4 + H2O – Trong dung dịch ta có cân bằng:
Cr,03 + H20 P 2Crox + 2H+
màu vàng
| màu da cam
Câu 2.
- a) K,Cr207 + 3H2S + 4H2SO4 + Cr2(SO4)3 + K2SO4 + 3S + 7H20 b) K,Cr207 + 14HCl → 2CrCl2 + 2KCl + 3Cl2 + 7H20 . . c) K,Cr,0, +6FeSO4+ 7H,SO4 + 3Fe, (SO4)3 + Cr2(SO4)3 + K2SO4 + 7H,0 Trong các phản ứng trên, K2Cr2O7 là chất oxi hóa; còn H2S, HCl,
FeSO, là chất khử; H2SO4 và HCl là môi trường. Câu 3.
Phản ứng trên là phản ứng oxi hóa – khử nội phân tử. . Câu 4. Phản ứng dụng phân tử: K_Cr207 + 3Na2S + 7H2SO4 + Cr2(SO4)3 + K2SO4 + 3Na2SO4
+35+ + 7H20 . Phản ứng dạng ion: Copy + 3So- + 14H+ + 2Cr3+ + 3O4 + 3H2O Câu 5. a) Phản ứng:
2CrCl3 + 3Cl2 + 16NaOH → 2Na2CrO4 + 12NaCl + 8H,0 – CrCl3 là chất khử vì số oxi hóa của crom trong hợp chất này tăng từ +3 lên +6 trong hợp chất Na2CrO4. – Cl2 là chất oxi hóa vì số oxi hóa của clo giảm từ 0 xuống -1. . b) Phản ứng: 2CrCl3 + Zn + 2CrCl2 + ZnCl2
– CrCl3 là chất oxi hóa, Zn là chất khử. c) Muối Cr (III) vừa có tính oxi hóa vừa có tính khử.
