








Nguồn website giaibai5s.com
Câu 1. Các kim loại Mg, Al thường được điều chế bằng phương pháp A, điện phân nóng chảy.
- thuy luyện. C. điện phân dung dịch.
- nhiệt luyện. Câu 2. Trong y học, hợp chất nào sau đây của natri được dùng trị bệnh dạ dày ? A. Na2SO4. B. Nal.
- Na2CO3. D. NaHCO3. Câu 3. Trong công nghiệp, để điều chế A1 người ta điện phân nóng chay chất nào sau đây ? A. AIC1z.
- Al2(SO4)3. C. Al2O3. D. Ali NO3)3. Câu 4. Nhiên liệu sạch đang được nghiên cứu sử dụng để thay thế một số nhiên liệu khác
gây ô nhiễm môi trường là nhiên liệu nào sau đây ? A. than đá.
- xăng, dầu. C. khí hiđro. D. khi butan (gas).
0
Câu 5. Phản ứng hoá học nào sau đây viết không đúng ? A. 2Fe + 312 -> 2Fe13.
- 3Fe + 202 Fež04. C. 2Fe + 3Cl2 + 2FeC1z. D. Fe + S + Fes. Câu 6. Fe và Cr phản ứng với chất nào sau đây đều tạo thành muối của kim loại có | hoá trị II ? A. Dung dịch HCl B. Cl2
C.S
- Dung dịch HNO3 Câu 7. Metyl fomat có công thức phân tử là
- CH402. B. C3H602. C. C4H2O2. D.C3H402. Câu 8. Poli(vinyl axetat) là polime được điều chế bằng phản ứng trùng hợp monome nào
sau đây ? A. C2H3COO-CH=CH2.
- CH2=CH-COO-CH3. C. CH2=CH-COO-C2H5.
- CH3COO-CH=CH2. Câu 9. Chất nào sau đây là amin bậc hai ?
- Metylamin. B. Trimetylamin. C. Phenylamin. D. Đmetylamin. Câu 10. Phương pháp nào sau đây không dùng để bảo vệ kim loại khỏi bị ăn mòn ?
- Bôi dầu mỡ lên bề mặt kim loại. B. Chế tạo vật dụng, chi tiết máy bằng hợp kim không gỉ (inox). C. Phủ một lớp sơn lên bề mặt kim loại.
- Ghép kim loại cần bảo vệ với một kim loại khác có tính khử yếu hơn. Câu 11. Cacbohiđrat nào sau đây trong phân tử có một gốc glucozơ và một gốc fructozơ ?
- Xenlulozơ B. Amilozơ C. Saccarozơ D. Anilopectin Câu 12. Chất có khả năng làm mềm nước cứng tạm thời là A. Naci.
- Na2SO4. C. Ca(OH)2. D. HCI. Câu 13. Cho hỗn hợp gồm 2,7 gam Al và 8,4 gam Fe vào 200 ml Cu(NO3)2 1M và
AgNO, 2M. Sau khi các phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là A. 34,4.
- 49,6. C. 54,4.
- 50,6. Câu 14. Hấp thụ hoàn toàn 0,1 mol CO2 vào 500 ml dung dịch NaOH x (mol/l), thu được
dung dịch chứa 9,72 gam chất tan. Giá trị của x là A. 0,48.
- 0,32. C.0.16.
- 0,18. Câu 15. Thí nghiệm nào sau đây tạo kết tủa trắng ?
- Cho mẩu natri vào ống nghiệm chứa etanol khan (dư). B. Cho vài giọt dung dịch CuSO4, vài giọt dung dịch NaOH vào ống nghiện chứa glixerol. C. Nhỏ từng giọt nước brom vào ống nghiệm đựng dung dịch phenol. D. Cho mấu canxi cacbonat vào ống nghiệm đựng dung dịch axit axetic đặc, dư.
Câu 16. Trường hợp nào sau đây không xảy ra phản ứng ?
- Saccarozo + Cu(OH)2. B. Fructozơ + H2 (xt Ni, t°). C. Fructozơ + dung dịch AgNO3 trong NH3.
- Saccazozơ + dung dịch AgNO3 trong NH3.
Câu 17. Xenlulozơ trinitrat được điều chế từ axit nitric và xenlulozơ (hiệu suất phản ứng
90% tính theo axit nitric). Để có 14,85 kg xenlulozơ trinitrat cần dung dịch chứa m kg axit nitric. Giá trị của m là A. 10,50.
- 8,51. C. 9,45.
- 11,50.
Câu 18. Hỗn hợp X gồm amin đơn chức và 02 có tỉ lệ mol 2 : 9. Đốt cháy hoàn toàn hỗn
hợp X, sau đó cho sản phẩm cháy qua dung dịch NaOH đặc, dư, thì thu được khí Y có tỉ khối so với H2 bằng 15,2. Số công thức cấu tạo của amin là A. 1. B. 2. C. 3.
- 4.
Câu 19. Phát biểu nào sau đây không đúng ?
- Ở điều kiện thường, photpho đo tác dụng với oxi tạo ra P205. B. Photpho phan ứng được với dung dịch HNO3 đặc, nóng. C. Photphorit và apatit là hai khoáng vật chứa photpho. D. Axit photphoric là axit ba nấc.
Câu 20. Nhận định nào sau đây không đúng ?
- HCOOH có tham gia phản ứng tráng bạc. B. CH3OH phản ứng với AgNO3/NH3 theo tỉ lệ mol tương ứng là 1 : 4 C. CH2=CH-COOH phản ứng được với dung dịch nước brom. D. Phenol không làm đổi màu quỳ tím.
Câu 21. Điện phân dung dịch hỗn hợp X gồm CuSO4 và NaCl (điện cực trơ, màng ngăn
xốp) đến khi nước bị điện phân ở cả hai điện cực thì dùng điện phân, thu được dung dịch Y và 784 ml hỗn hợp khí Z (đktc). Y hoà tan vừa đu 2,9 gam Fe3O4. Gia sư toàn bộ khí thoát ra khỏi dung dịch, hiệu suất của quá trình điện phân là 100%. Khối lượng Y giam so với X là A. 5,04 gam. B. 1,51 gam. C. 9,19 gam. D. 5,3i gam.
Câu 22. Xà phòng hoá hỗn hợp các este có công thức phân tử C4H60 bing một lượng
vừa đủ dung dịch NaOH sẽ thu được tối đa số san phẩm có phản ứng trang bạc là A. 3. B. 2. C.1.
- 4.
Câu 23. Cho sơ đồ phản ứng sau:
A_+H20 >B_+ NaOH C_+02xt »D_02 >E_+02 + Hụ0 »F Biết rằng các chất A, B, C, D, E, F đều có chứa nitơ trong phân tử A có công thức CH4N20. Nhận định nào sau đây không đúng ? A. Chất B có tính chất lưỡng tính. B. Chất C có tính bazơ. C. Chất E tác dụng với dung dịch NaOH tạo hỗn hợp 2 muối.
- Chất F chỉ có tính oxi hoá. Câu 24. Dãy các chất nào sau đây đều tác dụng được với dung dịch NaOH loãng ?
- ClH3NCH2COOH, CH3NH2 và H2NCH2COOH. B. CH3COONH3CH3, CH3NCH2COOCH3 và H2NCH2COOC2H5. C. H2NCH2COONH4, (CH3)2NH và C6H5NH3Cl (phenylamoni clorua).
- H2NCH2COOH, CH3NH3Cl và H2NCH(CH3)COONa. Câu 25. Cho các phương trình hoá học sau : (1) Fe + S + > Fes
(2) 2Fe+ 3Cl2 _> 2FeC13 (3) Cr+s _ > Crs
(4) 2Cr + 6HCl → 2CrC1; + 3H2T (5) Fe + AgNO3 (du) → Fe(NO3)2 + 2Ag (6) 2K2CrO4 + 2HCl → K2Cr202 + 2KCI + H20 Trong các phương trình hoá học trên, số phương trình hoá học viết đúng là A. 2.
C.4.
D.5 Câu 26. Đốt cháy hoàn toàn 0,1 mol hỗn hợp X gồm hai este thu được 5,6 lít CO2 (đktc).
ác thuỷ phân hoàn toàn X trong NaOH dư thu được hỗn hợp 2 ancol kế tiếp trong dãy đồng đẳng và muối của một axit cacboxylic duy nhất. Công thức của hai este là A. HCOOC2H5 và HCOOC3H7.
- CH3COOCH3 và CH3COOC2H5. C. CH3COOC2H4 và CH3COOCH3. D. HCOOCH3 và HCOOC2H5. Câu 27. Cho dãy các chất : Al, Al2O3, Al2(SO4)3, ZnO, Sn(OH)3, Zn(OH)2, NaHS,
KHSO3, KHSO4, Fe(NO3)2, (NH4)2CO3. Số chất trong dãy đều phản ứng được với dung dịch HCl và dung dịch NaOH là A. 7. B. 9. C. 10.
- 8. Câu 28. Cho một đipeptit Y có công thức phân tử C4H 2NO3. Số đồng phân cấu tạo của
Y là A. 6. B.5. C. 3.
- 8.
- 3.
Câu 29. Cho các phát biểu sau :
(1) NaOH được điều chế bằng cách điện phân dung dịch muối ăn có màng ngăn. (2) Có thể sử dụng dung dịch Na3PO4 để làm mềm nước có tính cứng vĩnh cửu. (3) Mg bùng cháy và phát nổ khi tiếp xúc với nước lạnh. (4) Na không tan trong dung dịch kiềm nhưng tan trong dung dịch axit. (5) NaHCO3 có thể sử dụng làm thuốc chữa bệnh, tạo nước giải khát. Trong các phát biểu trên, những phát biểu đúng là
- (1), (2), (4). B.(1), (3), (4). C. (2), (3), (5). D. (1), (2), (5). Câu 30. Ancol X tác dụng được với Cu(OH)2. Đốt cháy hoàn toàn m gam X cần x lít O2
(đktc), thu được 0,4 mol CO2 và 0,6 mol H2O. Giá trị của m và x lần lượt là A. 9,2 và 8,96. B. 12,4 và 13,44. C. 12,4 và 11,2. D. 9,2 và 13,44.
Câu 31. Cho ba dung dịch X, Y, Z thoả mãn:
– X tác dụng với Y thì có kết tủa xuất hiện. – Y tác dụng với Z thì có kết tủa xuất hiện. – X tác dụng với Z thì có khí bay ra. Các dung dịch X, Y, Z lần lượt là: A. KHCO3, Ba(OH)2, K2SO4.
- NaHCO3, Ba(OH)2, KHSO4. C. NaHCO3, Ca(OH)2, Mg(HCO3)2. D. AICI;, AgNO3, KHSO4. Câu 32. X có vòng benzen và có CTPT là C9H8O. X tác dụng dễ dàng với dung dịch
brom thu được chất Y có công thức phân tử là C9H8O2Br2. Mặt khác, cho X tác dụng với NaHCO3 thu được muối Z có CTPT là C,H,ONa. Số công thức cấu tạo của X là A. 4.
- 6. C.3.
- 5.
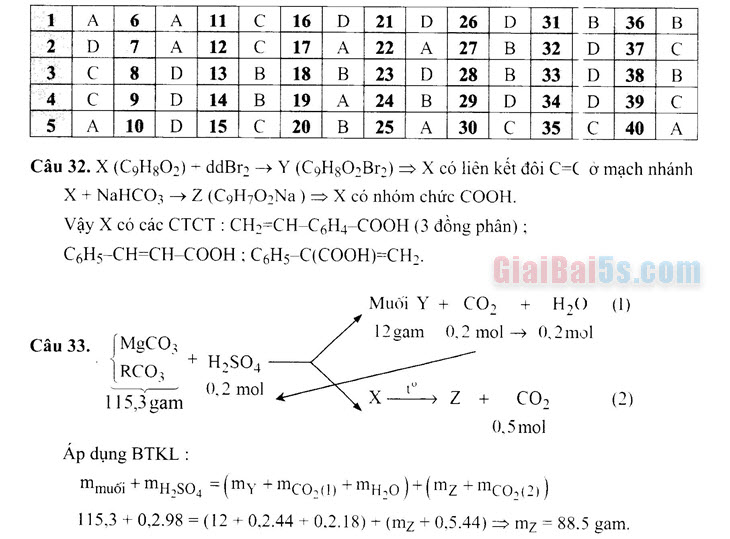
Câu 33. Cho 115,3 gam hỗn hợp hai muối MgCO3 và RCO3 vào dung dịch H2SO4 loãng,
thu được 4,48 lít khí CO2 (đktc), chất rắn X và dung dịch Y chứa 12 gam muối. Nung
X đến khối lượng không đổi, thu được chất rắn Z và 11,2 lít khí CO2 (đktc). Khối lượng của Z là A. 92,1 gam. B. 80,9 gam. C. 84,5 gam. D. 88.5 gam.
|| Ống 2
Ống 1:
Câu 34. Cho phản ứng giữa lưu huỳnh
với hiđro như hình vẽ bên. Nhận xét nào sau đây không đúng ? A. Ông (2) xuất hiện kết tủa đen. B. Ông (1) tạo khí H2.
Zn + HC! C. Để nhận ra sản phẩm có thể
dùng dung dịch CuCl2 ở ống (2). D. Nếu dùng dung dịch Cd(NO3)2 ở ống 2 thì thu được kết tủa trắng.
dd Pb(NO3)2
Câu 35. Kết quả thí nghiệm của các dung dịch X, Y, Z, T với thuốc thử được ghi lại
trong bảng sau : Mẫu thử Thuốc thử
| Hiện tượng Dung dịch H2
Có màu xanh tím Nước Br2
Kết tủa trắng NaHCO3
Có khi thoát ra T | Dung dịch AgNO3 trong NH3 đun nóng | Kết tủa Ag trắng bạc Các dung dịch X, Y, Z, T lần lượt là : A. Anilin, hồ tinh bột, axit axetic, metyl fomat. B. Hồ tinh bột, metyl fomat, axit axetic, anilin. C. Hổ tinh bột, anilin, axit axetic, metyl fomat.
- Hồ tinh bột, anilin, metyl fomat, axit axetic. Câu 36. Đốt cháy hoàn toàn a mol X (là trieste của glixerol với các axit đơn chức, mạch hở),
thu được b mol CO2 và c mol H2O (b – c = 4a). Hiđro hoá m1 gam X cần 6,72 lít H2 (đktc), thu được 39 gam Y (este no). Đun nóng m gam X với dung dịch chứa 0,7 mol NaOH, cô cạn dung dịch sau phản ứng, thu được m gam chất rắn. Giá trị của m là A. 57,2.
- 52,6. C. 53,2. D. 42,6. Câu 37. Cho 10,22 gam hỗn hợp gồm Al, Cu và Ag tác dụng vừa đủ với 280 ml dung
dịch HNO3 2M, thu được dung dịch chứa m gam muối và 1,12 lít hỗn hợp khí X (đktc) gồm NO và N20. Ti khối của X so với H2 là 16,4. Giá trị của m là
- 22,62. B. 37,50. C. 39,90. D. 25,02. Câu 38. Hỗn hợp M gồm este đơn chức X, hai anđehit đồng đẳng kế tiếp Y và Z (My<Mz).
Đốt cháy hoàn toàn 0,2 mol hỗn hợp M cần vừa đủ 8,4 lít khí O2 (đktc), thu được 7,84 lít khí CO2 (đktc) và 5,4 gam H2O. Đun 0,2 mol hỗn hợp M với dung dịch NaOH vừa đủ rồi thêm dung dịch AgNO3 trong NH3 tới khi thu được lượng kết tủa lớn nhất là m gam. Giá trị của m là A. 64,8. B. 75,6. C. 54.
- 43,2. Câu 39. Cho 3,9 gam hỗn hợp M gồm hai kim loại X, Y có hoá trị không đổi lần lượt là
(II) và (III) vào dung dịch H2SO4 loãng (dư), sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch A và 4,48 lít khí H2 (đktc). Mặt khác, cho 3,9 gam hỗn hợp M tác dụng vừa đủ với V lít dung dịch HNO3 1M, sau phản ứng thu được 0,84 lít khí B duy nhất (đktc) và dung dịch C. Cô cạn cẩn thận dung dịch C được 29,7 gam muối khan. Giá trị của V là A. 0,20
- 0,35. C. 0,50.
- 0,70.
Câu 40. Cho 37,70 gam hỗn hợp E gồm X (công thức phân tử là C3H2O3N2) và Y (công
thức phân tử là CH-ONS) tác dụng với 350 ml dung dịch KOH 2M đun nóng. Sau khi phản ứng xảy ra hoàn toàn thu được 11,2 lít (đktc) một khí Z làm xanh giấy quỳ âm và dung dịch T. Cô cạn T thu được m gam chất rắn khan. Giá trị của m là A. 50,6.
- 52,4. C. 45.
- 63.6.
1 A 6 A 2D7 A 3 C 8 D 4 C 9 D 5 A | 10 D
11 c 12C 13 B 14 B 15 C
16 17 18 19 20
D A B A B
21 22 23 24 25
D A D B A
26 D 27 B 28 B 29 D 30C
31 32 33 34 35
B D D D C
36 B. 37 C 38 B. 39 C. 40 A
Câu 32. X (CHO))+ ddBr2 + Y (C9H80 Br2 = X có liên kết đôi C=( ở mạch nhánh
X+ NaHCO3 → Z (CH-ONa )= X có nhóm chức COOH. Vậy X có các CTCT : CH2=CH-C6H4-COOH (3 đồng phân); C6H5-CH=CH-COOH ; C6H5-C(COOH)=CH2.
12 gam
0.2 mol 0,2 mol
Câu 33. (MgCO
RCO; + H250
(2)
0,2 mol
m x _ 115,3 gam
Z + CO2
0,5 mol Áp dụng BTKL: Mmuối + MH,804 = (my + mc03(1) + m420)+(mz + mc02(21) 115,3 +0,2.98 = (12 +0,2.44 +0,2.18) + (mz +0,5.44) > mz = 88.5 gam.
Câu 36. b = c = 4a = Độ bất bão hoà A = 5
9X có 2 liên kết C=C (hoặc 1 liên kết ba) = X + 2HẠY
NH,
2 = 0,15 (mol); my = 39 -0,3.2 = 38,4 (gam) = m/
nx =
ml + mNaOH = m2 + mgliserol => 38,4 + 40.0,7 = m2 +92.0,15 => m2 = 52,6 gam.
Câu 37. nx = 0,05 mol; nHNO, = 0,56 mol; Mx = 32,8 > nNO = 0,04 mol, nn,0 = 0,01 mol
4H® + NO3 + 3e + NO + 2H20 10H” + 2 NO3 + 8e → N2O + H2O (mol) 0,16 0,12 0,04
0,1
0,08 0,01 = n – = 0,26 mol< 0,56 mol = tạo muối amoni.
| 10H + NO + 8e → NH4 + 3H2O (mol) 0,3
0,24 0,03 mmuối = mkl + m no+ MNH, NOZ
mmuối = 10,22 + (0,12 – 0,08 + 0,24).62 + 0,03.80 = 39,9 (gam).
Câu 38. Số nguyên tử C trung bình trong M = 0
= 1,75
0,2
– Trong M cóY : HCHO và Z: CH3CHO. Gọi a là số mol este, b là số mol anđehit = a + b = 0,2 Áp dụng BTNT 0: 2a + b + 2 8.4 = 27,84 – 4
(2) * 22,4 “22,4 18 >> a = 0,05; b = 0,15. Gọi độ bất bão hoà của X là k. → nCO, – nụ,0= 0,05.(x – 1) =k = 2= Este không no. Gọi số nguyên tử C trong X là m, số nguyên tử C trung bình của 2 anđehit là n. →nco, = 0,05.m + 0,15.n = 0,35 = m + 3n = 7
Vì m> 3, nguyên ; 1 <n<2 m = 3, n = = =X: HCOOCH=CH,
– Sau xà phòng hoá thu được : HCOONa (0,05 mol) và CH3CHO (0,05 mol) n=4=HCHO : 0,1 mol : CH3CHO : 0,05 mol.
Vậy nAg = 2nHCOONa + 2nCH,CHO + 4nHCHO = 0,7 mol = mAg = 75.6 gam.
Câu 39. X+x -2e: YoY- -3e : 2H -2e → H,
= ne cho = 2.0,2 = 0,4 (mol) muối nitrat cua KL = mx +62.no =mKL +62.2nso
= 3.9 +62.2.0.2 = 28.7(gam) < 29,7 gam – Ngoài muối NO của hai kim loại còn có muối NH4NO. > nNH,no; = 27128.7 =0,0125(mol) 80
0.84 Gọi công thức khí B là NÀO : B = = 0,0375(mol).
22.4
+
X NO3 + (6x – 2y)HTM + (5x – 2y)e → NO: – (3x – y)H30
NO3 + 10 H + 8e • NHỊ – 3 HO Ta có ne nhậu = (3x – 2y). 0,0375 + 8. 0,0125 = (3x – 2y).0.0375 – 0, ne cho = 0,4 => Theo ĐLBT electron :(5x – 2y).0,0375 – 0,1 = 0,4 – 5x – 2y = 8 = x = 2 và y = 1 = B là N-0.
nHN), = nH+ =((x – 2y).0,0375 + 10.0,0125 = 0,5 (mol)=V= (0,5. Câu 40. CTCT của X :(CH3NH3)2CO CTCT cua Y: CH3NH3HSO,
(CH3NH 3 )2CO3 – 2KOH → K2CO3 + 2CH3NH2 + 2H20
CH3NH:HSO4 – 2KOH → K2SO4 + CH3NH2 + 2H20 Ta có 37.7 = 0,292 <ng < 37.7 = 0,304 129
124 nOH = 2ng < 0,61 < 0,7 = KOH dư (2x + y = 0.5
{ x = 0,2
= m = 0.2.138 + 0.1.174 +0.1.56 = 50,6 (gam). 124x + 129y = 37,7 ly = (),1
