| A. KIẾN THỨC CẦN NHỚ
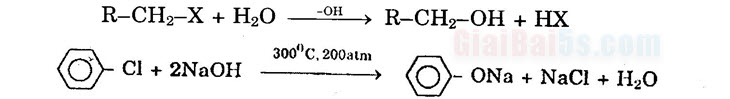
Tính chất hóa học 1) Phản ứng thế nguyên tử halogen bằng nhóm –OH:
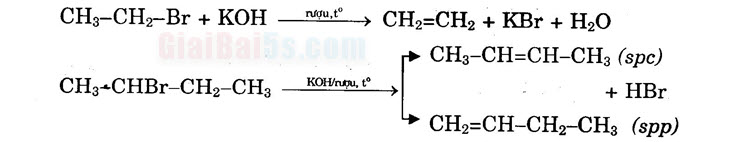
2) Phản ứng tách hiđro halogenua:
Quy tắc Zai-xếp: Khi tách HX khỏi dẫn xuất halogen, nguyên tử halogen X ưu tiên tách ra cùng với nguyên tử H ở cacbon bậc cao hơn bên cạnh tạo sản phẩm chính. 3) Phản ứng với magie tạo hợp chất cơ magie:
|

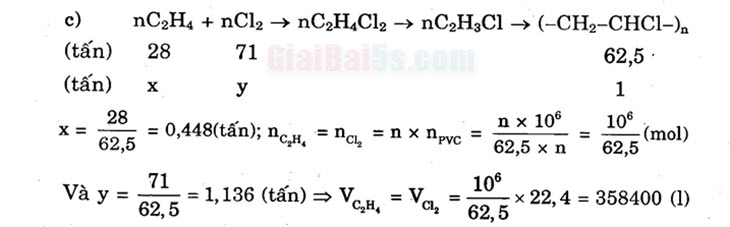
Nguồn website giaibai5s.com
- HƯỚNG DẪN GIẢI VÀ ĐÁP ÁN BÀI TẬP SGK TRANG 215 – 216 . Câu 1.
Gọi tên theo 2 cách: a) CHI: metyl iođua (tên gốc – chức); 1
Bậc I iolometan (tên thay thế). “
ete khan
CHI,: iođofom (tên thông thường); 1
triodometan (tên thay thế). Ở Bậc I BrCH,CH,CH,CH,Br: 1,4 – đibrombutan (tên thay thế);
| buta -1,4 đibromua (tên gốc – chức). | Bậc I CH,CHFCH: 2 – flopropan (tên thay thế); 1
isopropylflorua (tên gốc – chức). 1 . Bậc II
(CH), CCICH,CH,:1– clo – 2 – metyl butan (tên thay thế); 1
tert – pentylclorua (tên gốc – chức).
Bậc III
- b) CH=CHCH,Br: 3 – brom prop -1- en (tên thay thế); 1 Bậc I
anlylbromua (tên gốc – chức). ]
C,H,CH,I: niotphenylmetan (tên thay thế); benzyliođua (tên gốc – chức). }
Bậc I | p – FC,H,CH,:1- flo – 4 – metyl benzen (tên thay thế); 1
- tolylflorua (tên gốc – chức). [ PS / . 0 – CIC,H,CH,CH,: 1- clo – 2 – etyl benzen (tên thay thế); | 0 – etylphenylclorua (tên gốc – chức). Độ II
} Bậc III m – FC8H: 1,3 – điflobenzen (tên thay thế); m – phenylendiflorua (tên gốc – chức).
Bậc III
zen
|
|
Câu 2.
Công thức cấu tạo (công thức lập thể) và gọi tên các đồng phân ứng với công thức phân tử.
- a) C2HCIF:
H
cock
–
och
Cis-1-clo-2-floeten trans-1-clo-2-floeten 1-clo-1- floeten b) CzHCI H H H
Cl. cl
C=0 CHź ci CHI
CH3 Cis-1-cloprop-1-en trans-1-cloprop-1-en 2-cloprop-l-en Câu 3.
- a) Sự biến đổi nhiệt độ sôi theo qui luật:
– Ở nhiệt độ thường các dẫn xuất CH3F, CH3Cl, CH2Br là chất khí, CHI là chất lỏng.
– Nhiệt độ sôi tăng khi X lần lượt được thay bằng F, Cl, Br, I. – Nhiệt độ sôi tăng khi số nguyên tử X tăng lên trong phân tử. – Nhiệt độ sôi tăng khi gốc ankyl tăng mạch cacbon.
– Nhiệt độ sôi của phenyl halogen cao hơn nhiệt độ sôi của ankyl halogenua.
- b) Nhiệt độ sôi của các dẫn xuất halogen cho trong bảng cao hơn nhiệt độ sôi của hiđrocacbon tương ứng. Ví dụ:
CH4 (tos = -162°C); C2H6 (tos = -89°C); C3Hg (t’s = -42°C) C6H6 (tos = 86°C); CH3F (tos = -78°C); C2HzC1 (tos = 12°C)
C3H,Br (tos = 71°C); C6HzC1 (tos = 132°C) Câu 4.
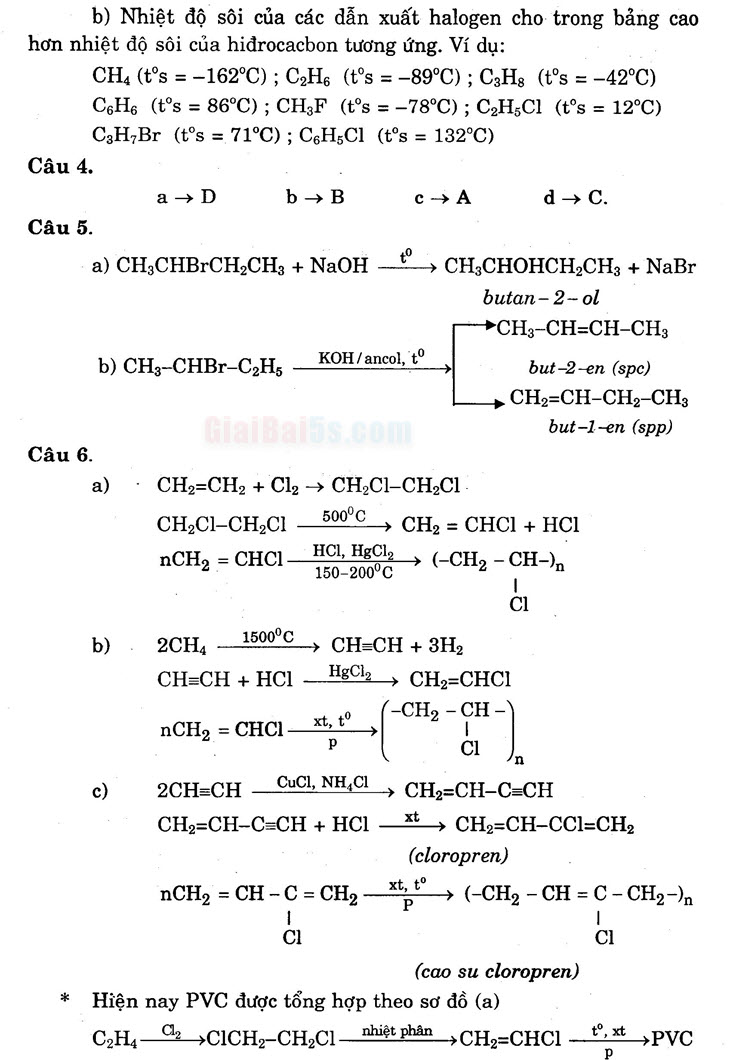
a →Db → B C →Ad → C. Câu 5. a) CH3CHBCH2CH3 + NaOH __ ; CH3CHOHCH2CH3 + NaBr
butan-2-ol
CH3-CH=CH-CH3 b) CH3-CHBr-C,H, KOH/ancol, to
but-2-en (spc) CH2=CH-CH2-CH,
but-1-en (spp) Câu 6. : a) · CH=CH2 + Cl2 → CH,Cl-CH2C1
CH,CI-CH,C1_500°C, CH, = CHCI + HCI nCH2 = CHCI HCl, Hgcla → (-CH2 – CH-),
…
Ći
b)
2CH 1500°C, CH=CH + 3H, CH=CH + HCI __ HgCl, — CH=CHCI nCH. – CHCI Xt, to (-CH2 – CH-)
- c) 2CH=CH 2 CuCl, NH4Cl + CH =CH-C=CH CH2=CH-C=CH + HCI __xt → CH2=CH-CC1=CH,
(cloropren) nCH, = CH -C = CH, -_ xt to → (-CH2 – CH = C-CH2-On ci : : :
(cao su cloropren) * Hiện nay PVC được tổng hợp theo sơ đồ (a)
CH, Cu +CACH-CH2Cl nhiệt phân -CH=CHCl to, x +PVC
Câu 7. Phân biệt các chất sau bằng phương pháp hóa học:
Có nhiều cách phân biệt. Cách phân biệt vận dụng bài học 49 là: a) Hexyl bomua, brombenzen, 1-brombut-2-en. CH3-(CH2);-Br.. C&HBr CHBr-CH=CH-CH3 (chất 1) (chất 2)
| (chất 3) – Lần lượt cho chất (1), (2), đem đun sôi với nước, gạn lấy lớp nước, axit hóa bằng HNO3, nhỏ vào đó dung dịch AgNO3, chỉ ống thử của chất (3) thuộc loại anlyl halogenua RCH = CHCH2X có kết tủa AgCl. Do vậy nhận ra chất (3).
– Lần lượt cho chất (1), (2) đem đun sôi với dd loãng NaOH, gạn lấy lớp nước, axit hóa bằng HNO3, nhỏ vào đó dung dịch AgNO3, chỉ ống thử của chất (1) thuộc loại ankyl halogenua có kết tủa AgCl. Do vậy nhận ra chất (1).
– Còn lại là chất (2). .. . b) 1-clopent-2-en
pent-2-en 1-clopentan. CICH,CH=CHCH,CH, CH2CH=CHCH.CH, CI(CH),CH (chất 1)
(chất 2)
(chất 3) – Lần lượt cho chất (1), (2), (3) đem đun sôi với nước, gạn lấy lớp nước, axit hóa bằng HNO3, nhỏ vào đó dung dịch AgNO3, chỉ ống thử của chất (1) thuộc loại anlyl halogenua RCH = CHCH2X có kết tủa AgCl. Do vậy nhận ra chất (1).
– Lần lượt cho chất (2), (3) đem đun sôi với da loãng NaOH, gạn lấy lớp nước, axit hóa bằng HNO3, nhỏ vào đó dung dịch AgNO3, chỉ ống thử của chất (3) thuộc loại ankyl halogenua có kết tủa AgCl. Do vậy nhận ra chất (3).
. – Còn lại là chất (2). Câu 8. a) (1) CH2=CH2 + Cl2 → CICH,-CH2C1
(2) CICH-CH2Cl _ KOH/rợu → CICH=CH2 + HCl
4HCI + O2 _ť → 2Cl2 + 2H20 b) Ưu điểm của qui trình này là khí clo được tận dụng tuần hoàn, tiết kiệm được nhiên liệu.
- c) (tấn) (tấn)
1
nC2H4 + nCl2 → nC2H4Cl2 → nCH,C1 = (-CH-CHC1-), 28 71
62,5 x y
1 .
– = 0,448(tấn); nc H. = nc, = n = newc =
n x 106 106
– (mol)
62,5 x n 62,5 71
28
x
=
62,5
Và y = 3 = 1,136 (tấn) V= , -9
22,4 = 358400 (1)
62,5