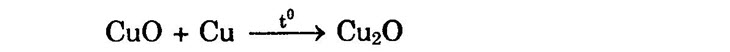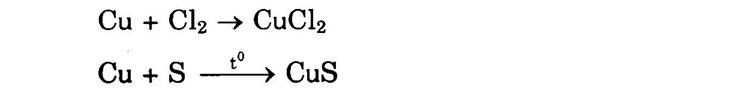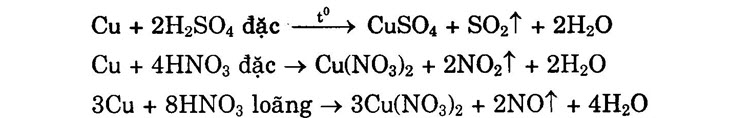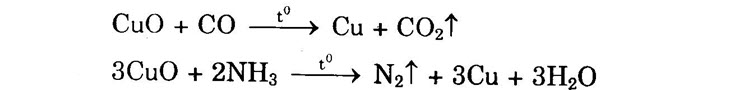| A. KIẾN THỨC CẦN NHỚ
§1. ĐỒNG I. Tính chất hóa học của đồng 1) Tác dụng với phi kim
Ở nhiệt độ cao hơn (800 – 1000°C) một phần CuO ở lớp bên trong oxi hóa Cu thành Cu2O màu đỏ:
Đồng có thể tác dụng với Cl2, Bra, s, … ở nhiệt độ thường hoặc đun nóng.
2) Tác dụng với axit 2Cu + 4HCl + O2 → 2CuCl2 + 2H2O Đồng bị oxi hóa dễ dàng trong H2SO4 đặc nóng và HNO3:
3) Tác dụng với dung dịch muối . Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓ §2. MỘT SỐ HỢP CHẤT CỦA ĐỒNG I. Đồng (II) oxit – CuO – CuO được điều chế bằng cách nhiệt phân các hợp chất Cu(OH)2, Cu(NO3)2, CuCo3.Cu(OH)2, …
– CuO có tính oxi hóa:
II. Đồng (II) hidroxit – Cu(OH)2 – Cu(OH)2 là chất rắn màu xanh. – Điều chế Cu(OH)2 từ dung dịch muối đồng (II) và dung dịch bazơ. – Cu(OH)2 có tính bazơ, không tan trong nước nhưng tan dễ dàng trong dung dịch axit. – Cu(OH)2 tan dễ dàng trong dung dịch NH3 tạo ra dung dịch có màu xanh lam thầm gọi là nước Svayde. Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 III. Đồng (II) sunfat – CuSO4 CuSO4 ở dạng khan là chất rắn màu trắng. Khi hấp thụ nước tạo thành muối hiđrat CuSO4.5H20 là tinh thể màu xanh trong suốt. Do vậy, CuSO4 được dùng để phát hiện dấu vết của nước trong các chất lỏng. |



Nguồn website giaibai5s.com
- HƯỚNG DẪN GIẢI VÀ ĐÁP ÁN BÀI TẬP SGK TRANG 213 Câu 1. Chọn C Câu 2. Chọn C Câu 3. a) Phản ứng điều chế: Cách 1: Cu + Cl2 -> CuCl2
| Cách 2: 2Cu + 4HCl + O2 → 2CuCl2 + 2H2O b) Tách riêng Ag và Cu: Cách 1. Đốt nóng trong không khí: 2Cu + O2 → 2Cu
Ag + O + không phản ứng Hòa tan hỗn hợp vào axit HCl: Ag không phản ứng tách riêng.
CuO → CuCl2 → Cu 110 :
Cách 2. Cho hỗn hợp tác dụng với dung dịch HNO3 loãng.
3Cu + 8HNO3 → 3Cu(NO3)2 + 2N0f + 4H20
Ag + 2HNO3 → AgNO3 + NOT + H20 Cô cạn dung dịch với nhiệt, ta được Ag và CuO.
Cu(NO3)2 -_ to → CuO + 2NO2 + 1/2O2
AgNO3 Ag + NO2 + 1/202 Cho hỗn hợp Ag và CuO tác dụng với dung dịch HCl, lọc thì thu được Ag. Điện phân dung dịch CuCl2, ta được Cu. Cách 3. Cho hỗn hợp tác dụng với dung dịch HCl với sự có mặt của oxi không khí, Cu tác dụng thành CuCl2, Ag không tác dụng, lọc lấy Ag, điện phân dung dịch CuCl2 thu được Cu.
2Cu + 4HCl + O2 → 2CuCl2 + 2H2O
CuCl2 — dpdd → Cu + Cl2 Câu 4.
- a) Dung dịch B có thể là axit HCl hoặc axit H2SO4 loãng: Phương trình: Fe + 2HCl → FeCl2 + H2 Khi khuấy kĩ, oxi không khí hòa tan vào dung dịch axit làm cho đồng tác dụng được với axit HCl hoặc H2SO4 loãng. ..
2Cu + 4HCl + O2 → 2CuCl2+ 2H,0 Fe và Cu bị hòa tan hết, Ag giữ nguyên không đổi. b) Dung dịch B là dung dịch AgNO3.
Fe + 3AgNO3 → Fe(NO3)3 + 3Ag!
Cu + 2AgNO3 → Cu(NO3)2 + 2Agt Fe và Cu bị hòa tan hết, Ag sinh ra làm cho khối lượng Ag tăng lên. Câu 5.
- a) Phản ứng: Fe + CuSO4 + FeSO4 +Cu Màu xanh của dung dịch CuSO4 nhạt dần.
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4 Màu vàng của dung dịch Fe2(SO4)3 nhạt dần, CuSO4 sinh ra làm dung dịch có màu xanh. b) Điện phân dung dịch CuSO4 bằng điện cực trợ:
2CuSO2 + 2H20 -→ 2Cu + O2T + 2H2SO4 Khi CuSO4 bị điện phân hết, dung dịch còn lại là dung dịch H2SO4 nên không có màu. – Điện phân dung dịch CuSO4 bằng điện cực đồng, có hiện tượng
dương cực tan.
Ở catot Cuot bị khử thành Cu, ở anot điện cực Cu bị oxi hóa. • ở catot : Cuo+ + 2e → Cu
ot; Cu – Cu2+ + 2e Cu* sinh ra làm cho màu dung dịch hầu như không thay đổi. Câu 6.
Xét 100 gam hợp kim 9 mol = 13,2 gam và mcu = 86,8 gam. Gọi hợp chất hóa học của tinh thể hợp kim Cu-Al có công thức Cu Aly. Theo đầu bài, ta có tỉ lệ x3y = 8 : 3 =x;y = 28 : 10
63,5 2 Vậy công thức hợp chất đó là Cu2gAlloCâu 7.
1 x 118 Theo đề bài, ta có: %msa = ;
– x 100% = 26,9%
- 1x 118 + 5 x 64 ” Vậy hàm lượng Sn trong hợp kim Cu-Sn là 26,9%.