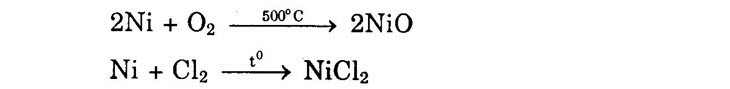| A. KIẾN THỨC CẦN NHỚ
§1. BẠC – Cấu hình electron nguyên tử Ag: [Kr]4d105s1. – Bạc rất mềm, dẻo, màu trắng, dẫn nhiệt và dẫn điện tốt nhất trong các kim loại. – Bạc là kim loại nặng (khối lượng riêng là 10,5 g/cm³), nóng chảy 960,5°C. – Bạc có tính khử yếu, nhưng ion Ag+ có tính oxi hóa mạnh (EºAg+/Ag = +0,8V). – Bạc không bị oxi hóa trong không khí dù ở nhiệt độ cao. – Bạc không tác dụng với HCl, H2SO4 loãng nhưng tác dụng với axit có tính oxi hóa mạnh như HNO3, hoặc H2SO4 đặc nóng. Ag + 2HNO3 (đặc) → AgNO3 + NO2↑+ H2O Bạc có màu đen khi tiếp xúc với không khí hoặc hơi nước có mặt hiđro sunfua. 4Ag + 2H2S + O2 → 2Ag2S↓ (đen) + 2H20 – Ion Ag+ (dù nồng độ rất nhỏ, chỉ khoảng 10-10 mol) có khả năng sát trùng, diệt khuẩn tốt. §2. VÀNG – Cấu hình electron nguyên tử Au: [Xe]4f15d106s1. – Vàng là kim loại mềm, màu v àng, dẻo. Vàng có tính dẫn điện và dẫn nhiệt tốt, chỉ kém bạc và đồng. – Vàng có khối lượng riêng là 19,3 g/cm³, nóng chảy ở 1063°C. – Vàng có tính khử rất yếu (EºAu3+/Au = +1,5V). Vàng không bị oxi hóa trong không khí ở bất kỳ nhiệt độ nào và không bị hòa tan trong axit nhưng bị hòa tan trong nước cường toan (hỗn hợp 1 thể tích HNO3 đặc và 3 thể tích HCl đặc). Au + HNO3 + 3HCl → AuCl2 + 2H2O + NO↑ • Dung dịch muối xianua của kim loại kiềm NaCN, tạo thành ion phức [Au(CN)2]‾. • Thủy ngân, tạo thành hỗn hống với Au (chất rắn màu trắng). Đốt nóng hỗn hống, thủy ngân bay hơi, còn lại vàng (chú ý tính độc hại của thí nghiệm này). §3. NIKEN – Cấu hình electron nguyên tử Ni: [Ar]3d84s2. – Niken là kim loại có màu trắng bạc, rất cứng, có khối lượng riêng bằng 8,91 g/cm³, nóng chảy ở 1455°C. – Niken có tính khử yếu hơn sắt (EºNi2+/Ni = -0,26V). – Niken có thể tác dụng với nhiều đơn chất và hợp chất.
– Ở nhiệt độ thường Ni bền với không khí, nước và một số dung dịch axit do trên bề mặt niken có một lớp màng oxit bảo vệ. §4. KẼM – Cấu hình electron nguyên tử Zn: [Ar]3d104s2. – Kẽm là kim loại có màu lam nhạt, giòn ở nhiệt độ phòng, dẻo ở nhiệt độ 100 – 150°C, giòn trở lại ở nhiệt độ trên 200°C. Kẽm có khối lượng riêng bằng 7,13 g/cm³, nóng chảy ở 419,5°C và sôi ở 906°C. – Kẽm là kim loại hoạt động, có tính khử mạnh. Kẽm tác dụng được với nhiều phi kim và các dung dịch axit, kiềm, muối. – Kẽm không bị oxi hóa trong không khí và trong nước vì trên bề mặt kẽm có màng oxit hoặc cacbonat bazơ bảo vệ. §5. THIẾC – Cấu hình electron nguyên tử Sn: [Kr]4d105s25p2. – Thiếc là kim loại màu trắng bạc, dẻo. Thiếc có nhiệt độ nóng chảy là 232°C và nhiệt độ sôi là 2620°C. – Thiếc có 2 dạng thù hình là thiếc trắng (7,92 g/cm3) và thiếc xám. (5,85 g/cm3). – Thiếc là kim loại có tính khử yếu hơn kẽm và niken. – Trong không khí, ở nhiệt độ thường Sn không bị oxi hóa; ở nhiệt độ cao Sn bị oxi hóa thành SnO2. – Thiếc tác dụng chậm với các dung dịch HCl, H2SO4 loãng tạo thành muối Sn(II) và H2. Với dung dịch HNO3 loãng tạo muối Sn(II) nhưng không giải phóng H2. Với H2SO4, HNO3 đặc tạo ra hợp chất Sn(IV). – Thiếc bị hòa tan trong dung dịch kiềm đặc (NaOH, KOH). §6. CHÌ – Cấu hình electron nguyên tử Pb: [Xe]4f145d106s26p2. – Chì có màu trắng hơi xanh, mềm (có thể cắt bằng dao, dễ dát mỏng và kéo sợi. . . . – Chì là kim loại nặng, có khối lượng riêng là 11,34 g/cm³, nóng. chảy ở 327,4°C và sôi ở 1745°C. – Chì có tính khử yếu. – Chì không tác dụng với các dung dịch HCl, H2SO4 loãng do các muối chì không tan bao bọc ngoài kim loại. Chì tan nhanh trong H2SO4 đặc nóng và tạo thành muối tan là Pb(HSO4)2. Chì tan dễ dàng trong dung dịch HNO3, tan chậm trong HNO3 đặc. – Chì cũng tan chậm trong dung dịch kiềm nóng (như NaOH, KOH). |




Nguồn website giaibai5s.com
- HƯỚNG DẪN GIẢI VÀ ĐÁP ÁN BÀI TẬP SGK TRANG 218 – 219 Câu 1. Chọn D
Vì Pb đứng sau Sn trong dãy hoạt động. Câu 2. Chọn C Câu 3.
Để mạ kim loại cho một vật, cần nắm nguyên tắc mạ điện: – Vật cần mạ là catot của thiết bị mạ.
– Kim loại mạ là anot của thiết bị mạ (anot sẽ tan).
– Dung dịch điện phân chứa cation kim loại mạ. Thiết bị mạ gồm bể điện phân chứa dung dịch điện phân. Tiếp xúc . với dung dịch điện phân là catot (vật cần mạ) và anot (kim loại để mạ), nguồn điện 1 chiều có điện áp thích hợp. Các phản ứng hóa học xảy ra: – Ở catot: cation kim loại mạ bị khử thành kim loại và bám vào bề mặt vật cần mạ.. – Ở anot: nguyên tử kim loại mạ bị oxi hóa thành cation và tan vào dung dịch mạ. Anot tan dần nên nồng độ cation trong dung dịch mạ hầu như không thay đổi. a) Catot: vật bằng thép, anot: kim loại Cu. Dung dịch điện phân là: CuSO4 Phản ứng ở catot : Cu2+ + 2e → Cu (bám vào vật cần mạ) Phản ứng ở anot : Cu + Cu2+ + 2e (Cu tan vào dung dịch). b) Catot: vật bằng thép, anot: kim loại Sn. Dung dịch điện phân là: Sn(NO3)2 . Phản ứng ở catot: Sn2+ + 2e → Snl (bám vào vật cần mạ) . Phản ứng ở anot: Sn -> Sn2+ + 2e (Snot tan vào dung dịch) c) Catot: vật bằng đồng, anot: kim loại Ag. Dung dịch điện phân là: AgNO3 Phản ứng ở catot: Ag + e > Ag (bám vào vật cần mạ)
Phản ứng ở anot: Ag + Ag + e (Ag tan vào dung dịch) Câu 4. Xem phần A lí thuyết. Câu 5. Gọi x là số mol Zn phản ứng:
Zn + CdCl2 → ZnCl2 + Cd (mol) x + x x x Vì khối lượng thanh kẽm tăng sau phản ứng nên ta áp dụng phương trình đại số sau :
mkim loại tàng = mkim loại tạo thành – m kim loại tan 3,29 = 112x – 65x => x = 0,07 = mca tạo thành = 0,07 x 112 = 7,84 (gam)
và muaC1, tạo thành = 0,07 x 136 = 9,52 (gam) Từ (1) = mcaCI, phản ứng = 0,07 x 183 = 12,81 (gam).
và mcaCl, a = 14,64 – 12,81 = 1,83 (gam). .
29
Câu 6.
Niken Đông
Kẽm Vị trí trong Kim loại nhóm | Kim loại nhóm | Kim loại nhóm bảng tuần | VIIIB, chu kỳ |IB, chu kỳ 4, số IIB, chu kỳ 4, số hoàn 4, số hiệu | hiệu nguyên tử | hiệu nguyên tử nguyên tử 28
20 Cấu hình e
[Ar]3d8482 [Ar]3d104s [Ar]3d104s? nguyên tử Số oxi hóa +1 và +2
+2 và +3
+2 Thế điện -0,23V -0,34V
-0,76V cực chuẩn Tính khử
Cu có tính khử | Zn là kim loại Ni có tính khử của các kim
yếu, kim loại | hoạt động, có yếu hơn sắt loại 1
kém hoạt động | tính khử mạnh. | Câu 7.
- a) Từ AgNO3 có thể điều chế kim loại bạc bằng cách điện phân hoặc dùng kim loại mạnh hơn (Cu, Fe, …) khử ion Ag” trong dung dịch.
- b) Từ ZnS và ZnCO3 điều chế kim loại bằng cách: – – Nung các hợp chất này trong không khí để chuyển về dạng oxit.
– Dùng các chất khử (C, co, …) để khử oxit ở nhiệt độ cao hoặc hòa tan oxit bằng dung dịch axit H2SO4 loãng rồi điện phân. .. c) Từ thiếc (IV) oxit điều chế kim loại thiếc bằng cách dùng cacbon khử ở nhiệt độ cao. d) Từ chì (II) sunfua điều chế kim loại chì bằng cách nung nóng hợp chất sunfua trong không khí thu được oxit, rồi dùng chất khử
(c. CO…) để khử ở nhiệt độ cao. Câu 8.
Gọi a là số mol của Cu và b là số mol của Ag. Phản ứng:
3Cu + 8HNO3 + 3Cu(NO3)2 + 2NOT + 4H20 (1) . (mol) a
а . Ag + 2HNO3 → AgNO3 + NO2T + H2O (mol) b→ 116 ..
2 + 1786 = 734 = (a = 0,03
|
Theo đề bài, ta có hệ phương trình:
(64a + 108b = 3
1188a + 178b = 7,34 lb’= 0,01 Vậy mcu = 0,04 x 64 = 1,92 (gam) và Ag = 0,01 x 108 = 1,08 (gam). Câu 9.
Gọi công thức sunfua kim loại là RS (x mol) và a là số mol O2 ban đầu. a) Phản ứng:
RS + 0, 1°, RO + S027 . (1) (mol) — 1,5x x x
RO + CO 2R + COT (mol) x +
x 0,5x O2 + 2Cuť → 2Cuo (mol) (a – 1,5x) b) Xác định công thức muối sunfua:
5,6 x 80
* = 0,2 (mol).
nuo
Ta có: nso, = 22,4 x 100
$ = 207 (g/mol).
Từ (1), (2) và (3) = ne = neo, = 0,2 (mol) = Mg = Vậy kim loại R là Pb; hợp chất sunfua là PbS.
0,2