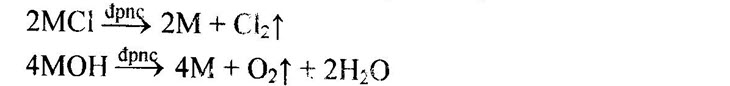| I. KIẾN THỨC CẦN NHỚ
1. Kim loại kiềm – Thuộc nhóm IA, đứng ở đầu mỗi chu kì (trừ chu kì 1). – Tính chất vật lí: có màu trắng bạc và có ánh kim, dẫn điện tốt, mềm, khối lượng riêng nhỏ, nhiệt độ nóng chảy và nhiệt độ sôi thấp, độ cứng thấp. – Có le ở lớp ngoài cùng (ns¹). – Tính chất hóa học: có tính khử mạnh nhất trong tất cả các kim loại (tác dụng với nước, axit, phi kim): M → M+ + e – Phương pháp điều chế: điện phân hợp chất nóng chảy
2. Một số hợp chất của kim loại kiềm – NaOH: có tính kiềm mạnh, được dùng để nấu xà phòng, chế phẩm nhuộm, tơ nhân tạo,… . – NaHCO3: có tính lưỡng tính, bị phân hủy bởi nhiệt, được dùng trong công nghiệp dược phẩm và thực phẩm. – Na2CO3: là muối của axit yếu, được dùng trong công nghiệp thủy tinh bột giặt, phẩm nhuộm, giấy, sợi,… – KNO3: có tính oxi hóa mạnh khi đun nóng, được dùng làm phân bón, chế tạo thuốc nổ. |



Nguồn website giaibai5s.com
- HƯỚNG DẪN GIẢI BÀI TẬP (SGK) Bài 1 (Trang 111, SGK) Cấu hình electron lớp ngoài cùng của nguyên tử kim loại là: ns’. Vì vậy, chúng ta chọn A.
Bài 2 (Trang 111, SGK) | Cation M’ có cấu hình electron ở lớp ngoài cùng là 2s22p. M’ là cation Na+.
Vì vậy, chúng ta chọn C. Bài 3 (Trang 111, SGK) Phương trình phản ứng: 2K + 2H20 – 2KOH + H2 nk = 20 = 1 (mol) = nkon = 1 (mol); NH2 = 0,05 (mol)
39
39
mdung dich – 39.+ 362 – 0,5 x 2 = 400 (g)
C%=1X36x100% = 14%
400 Vì vậy, chúng ta chọn C.
Bài 4 (Trang 111, SGK) Trong các muối đã cho muối dễ bị nhiệt phân là KHCO3. Vì vậy, chúng ta chọn C. Bài 5 (Trang 111, SGK) Ta có: nghi = 2 = 0,04 (mol)
22,4 Suy ra nkim loại =2 x 0,04 = 0,08 (mol)
^ = 39. Vậy muối clorua: KCI.
0,04 x 2 Bài 6 (Trang 111, SGK) . Phương trình phản ứng: CaCO3 + 2HCI → CaCl2 + CO21 + H2O ncaco, = 100 = 1 (mol) =nco, = 1 (mol)
MKL = _ 3,12
.
100
100
NaOH
–
= 1,5 (mol)
40
Vì 1 < nNaOH : no, = 1,5 <2. Do đó tạo thành 2 muối. CO2 + NaOH + NaHCO3 xmol xmol
xmol CO2 + 2NaOH : Na2CO3 + H2O ymol. ymol
ymol . . Ta có hệ phương trình: (x + y =1 1x+2y = 1,5 >* m NaHCO; = 84 * 0,5 = 42 (8) m Na,co= 106 * 0,5 = 53 (g) Khối lượng muối thu được: 42 + 53 = 95 (g) Bài 7 (Trang 111, SGK) 2NaHCO3 __”>Na2CO3 + CO2+ + H2O “.
x=y= 0,5
Theo định luật bảo toàn khối lượng:
mu,b+ mCo, = mAh đầu – chất rắn sau = 100 – 69 = 31 (g) Gọi x = neo, = nH,0 tạo thành = 18x + 44x = 31 3x= 0,5 (mol) N Naico, = 2 *0,5 = 1 (mol) = m Nahco; = 1 * 84 = 84 (g)
NaH
%m NaHCO3
Om Nahico = 84
100
.
:
0
* = 84% = % mna,co; = 100 – 84 = 16% Bài 8 (Trang 111, SGK) a. Gọi công thức chung của 2 kim loại kiềm là M. M + H2O → MOH + – H2 nu = 0,05 (mol) = nm = 0,1 (mol) = M = *7 = 31 (g/mol) Vậy hai kim loại đó là Na và K. Gọi x là số mol kim loại Na, ta có: 23x + 39 * (0,1 – x) = 3,1 + x = 0,05
23×0,05% 100% %mna = %mk = 100% – 37,1% = 62,9% b. H+ + OH → H20. Nici = n = nmoh= 0,1.(mol) Suy ra: Vung dịch HCI- 9 = 0,05 (lít) mình muối =(31 + 35,5) = 0,1 = 6,65 (g)
-= 37,1%