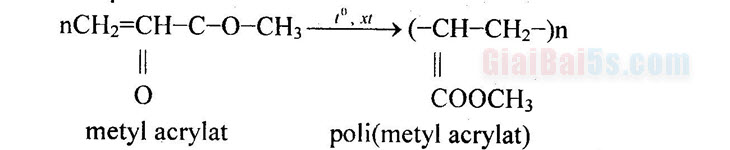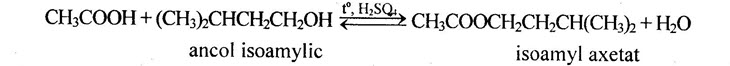| I. KIẾN THỨC CẦN NHỚ
1. Khái niệm về este a. Cấu tạo phân tử Khi thay nhóm -OH ở nhóm cacboxyl của axit cacboxylic bằng nhóm -OR thì được este. Este đơn giản có công thức cấu tạo như sau: Với R, R’ là gốc hiđrocacbon no, không no hoặc thơm (trừ trường hợp este của axit fomic có R và H). Este là dẫn xuất của axit cacboxylic. Một vài dẫn xuất khác của axit cacboxylic có công thức cấu tạo như sau:
c. Tính chất vật lí của este Giữa các phân tử este không có liên kết hiđro, vì thế este có nhiệt độ sôi thấp hơn so với axit và ancol có cùng số nguyên tử C. Các este thường là những chất, lỏng, nhẹ hơn nước, rất ít tan trong nước, có khả năng hòa tan được nhiều chất hữu cơ khác nhau. Những este có khối lượng phân tử rất lớn có thể ở trạng thái rắn (như mỡ động vật, sáp ong…). Các este thường có mùi thơm dễ chịu, chẳng hạn isoamyl axetat có mùi chuối chín, etyl butirat có mùi dứa, etyl isovalerat có mùi táo,… 2. Tính chất hóa học của este a. Phản ứng ở nhóm chức – Phản ứng thủy phân: Este bị thủy phân trong môi trường axit hoặc môi trường bazơ. Thủy phân este trong môi trường axit là phản ứng nghịch với phản ứng este hóa:
Phản ứng thủy phân trong dung dịch kiềm là phản ứng một chiều và còn được gọi là phản ứng xà phòng hóa:
– Phản ứng khử: Este bị khử bởi liti nhôm hiđrua (LiAIH), khi đó nhóm (gọi là nhóm axyl) | trở thành ancol bậc I:
b. Phản ứng ở gốc hiđrocacbon Este có thể tham gia phản ứng thế, cộng, tách, trùng hợp,… Sau đây chỉ xét phản ứng cộng và phản ứng trùng hợp. – Phản ứng cộng vào gốc không no: Gốc hiđrocacbon không no ở este có phản ứng cộng với H2, Br2, Cl2,… giống như hiđrocacbon không no. Ví dụ
Ví dụ:
3. Điều chế và ứng dụng a. Điều chế – Este của ancol Phương pháp thường dùng để điều chế este của ancol là đun hồi lưu ancol với axit hữu cơ, có H2SO4 đặc xúc tác, phản ứng này được gọi là phản ứng este hóa. Ví dụ: – Este của phenol: Để điều chế este của phenol không dùng axit cacboxylic mà phải dùng anhiđrit axit hoặc clorua axit tác dụng với phenol. Ví dụ: C6H5-OH + (CH3CO2)O →CH3COOC6H5 + CH3COOH anhiđrit axetic phenyl axetat b. Ứng dụng Este có khả năng hòa tan tốt các chất hữu cơ, kể cả hợp chất cao phân tử, nên được dùng làm dung môi (Ví dụ: butyl và amyl axetat được dùng để pha sơn tổng hợp). Poli(metyl metacrylat) dùng làm thủy tinh hữu cơ, poli(vinyl axetat) dùng làm chất dẻo hoặc thủy phân thành poli(vinyl ancol) dùng làm keo dán. Một số este của axit phtalic được dùng làm chất hóa dẻo, làm sản phẩm. Một số este có mùi thơm của hoa quả được dùng trong công nghiệp thực phẩm (kẹo bánh, nước giải khát) và hoá mỹ phẩm (xà phòng, nước hoa…). |


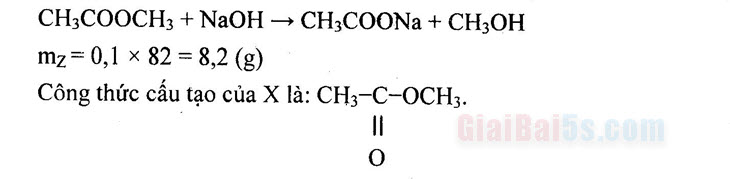
Nguồn website giaibai5s.com

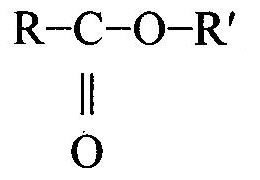
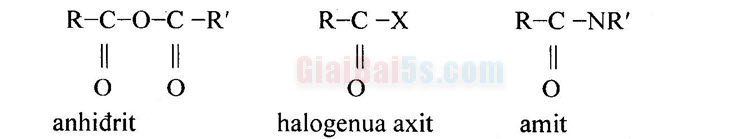 b. Cách gọi tên este: Tên este gồm: Tên gốc hiđrocacbon R’ + tên anion gốc axit (đuôi “at”).
b. Cách gọi tên este: Tên este gồm: Tên gốc hiđrocacbon R’ + tên anion gốc axit (đuôi “at”). 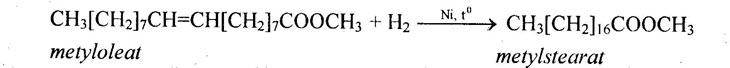 – Phản ứng trùng hợp: Một số este đơn giản có liên kết C=C tham gia phản ứng trùng hợp giống như anken.
– Phản ứng trùng hợp: Một số este đơn giản có liên kết C=C tham gia phản ứng trùng hợp giống như anken.