








Nguồn website giaibai5s.com
Câu 1. Để điều chế Cu người ta tiến hành điện phân | A. điện phân dung dịch CuCl2.
- điện phân nóng chảy CuCl2. C. điện phân nóng chảy Cu(NO3)2.
- điện phân nóng chảy CuO. Câu 2. Thạch cao sống có công thức là
CaSO4.H20. B. CaSO4. C. CaCO3. D. CaSO4.2H20. Câu 3. Hợp chất Al(OH)3 không tác dụng được với dung dịch nào sau đây ? A. NaOH
HC1 C. BaCl2
H2SO4
Câu 4. Nguyên nhân nào sau đây không gây ô nhiễm môi trường không khí ?
(A) Hoạt động của núi lửa. (B) Khí thải công nghiệp, khí thải sinh hoạt. (C) Khí thải từ các phương tiện giao thông.
(D) Khí sinh ra từ quá trình quang hợp của cây xanh. Câu 5. Dung dịch muối nào sau đây khi cho vào dung dịch HCl, đun nóng sẽ có phản ứng
xảy ra ?
- FeBr2 B. FeSO4; C. Fe(NO3)2 D. Fe(NO3)3 Câu 6. Chất nào sau đây có tính lưỡng tính? A. Cor B. Cro
- Cr2O3 D. CrO; Câu 7. Este X có công thức phân tử C4H6O2. Thuỷ phân hoàn toàn X bằng dung dịch
NaOH, thu được dung dịch Y chứa hai chất đều có khả năng tham gia phản ứng tráng bạc. Công thức cấu tạo của X là A. CH2=CH-COO-CH3. : B. HCOO-CH2-CH=CH2.
- HCOO-CH=CH-CH3. 1..” D. CH3-COO-CH=CH2. Câu 8. Chất nào sau đây làm quỳ tím hoá xanh? A. anilin
- alanin C. axit glutamic D. metylamin Câu 9. Vật liệu polime được tạo ra từ sản phẩm của phản ứng trùng ngưng axit
£-aminocaproic là
- tơ nhân tạo. B. chất dẻo. C. tơ tổng hợp. D. cao su. Câu 10. Ở nhiệt độ cao, khí CO không khử được oxit nào sau đây ? A. CuO B. Fe203 C. PbO
- Al2O3 Câu 11. Dung dịch glucozơ dùng làm dịch truyền để tăng lực cho người ốm. Công thức
phân tử của glucozơ là
- C6H1206. B. C12H22011. C. C4H1005. D. CH20. Câu 12. Dung dịch NaOH không tác dụng với dung dịch chất nào sau đây ? A. KNO3 B. MgCl2 C. CuSO4
- FeCl :. Câu 13. Dẫn luồng khí CO dư đi qua 2,4 gam hỗn hợp CuO và Fe2O3 nung nóng đến khi
phản ứng xảy ra hoàn toàn, thu được 1,76 gam chất rắn. Phần trăm khối lượng CuO có trong hỗn hợp ban đầu là A. 55,28%. B. 45,72%.
7%.
- 33,33%. Câu 14. Hoà tan hoàn toàn 3,6 gam hỗn hợp gồm MgO và Ca cần một lượng vừa đủ
m gam dung dịch HCl 7,3%. Giá trị của m là A. 90.
180. C. 45.
135.
Câu 15. Hình bên dùng để điều chế và thu khí của (1)
phản ứng nào sau đây ? A. MnO2 + 4HCI → MnCl2 +Cl2 + 2H20… B. NH4Cl + NaOH → NaCl + NH3 + H20. . C. Ag + 2HNO3 → AgNO3 + NO2 + H20.. D. A14C3 + 12HCl → 4AICl3 + 3CH4.
H20 Câu 16. Nhận định nào sau đây sai ?
- Các este nhẹ hơn nước nên chúng không tan trong nước. B. Chất béo thuộc loại este. C. Chất béo lỏng ở điều kiện thường là các triglyxerit của axit béo không no.
- Tripeptit là hợp chất mà trong phân tử có 2 liên kết peptit. Câu 17. Đốt cháy hoàn toàn tinh bột cần V lít O2 (đktc), sau phản ứng thu được CO2 và
H50. Hấp thụ hết sản phẩm cháy vào nước vôi trong dư thu được 50 gam kết tủa. Giá trị của V là A. 16,8. E B . 8,40.
- 11,2.
- 7,84. i Câu 18. Dãy gồm các chất được sắp xếp theo thứ tự giảm dần lực bazơ từ trái sang phải là :
- Phenylamin, amoniac, metylamin. B. Metylamin, amoniac, phenylamin. C. Metylamin, phenylamin, amoniac.
- Phenylamin, metylamin, amoniac. Câu 19. Phản ứng nào sau đây không đúng? A. 2NaCl + 2H20 apdd → 2NaOH + Cl2 + H2
mn B. Fe + 2HCl → FeCl2 + H2 C. Cu + H2SO4 đặc, to + CuSO4 + H2
- 2Na + 2H2O + 2NaOH + H2 Câu 20. Phản ứng nào sau đây không đúng ?
- CH3CHO + H2 to, xt → CH3OH B. CH4 +02 to, xt → HCHO+ H2O C. 2C2H4 +02 __°,xt → 2CH3CHO
- CH3OH + COto, xt > CH3COOH Câu 21. Hoà tan hoàn toàn hỗn hợp X gồm CuSO4 và KCl vào H2O, thu được dung dịch Y.
Điện phân Y (có màng ngăn, điện cực trơ) đến khi H2O bắt đầu điện phân ở cả hai điện cực thì dùng điện phân. Số mol khí thoát ra ở anot bằng 4 lần số mol khí thoát ra từ catot. Phần trăm khối lượng của CuSO4 trong X là A. 61,70%.
- 44,61%. C. 34,93%. D. 50,63%.
Câu 22. Cho hợp chất hữu cơ X có công thức là C4H6O2 tác dụng với NaOH, sau phản
ứng thu được một muối của axit hữu cơ Y và một hợp chất hữu cơ Z không phản ứng với Na. Số chất thoả mãn điều kiện trên là A. 2. B. 3. C.1.
- 4. Câu 23. Thí nghiệm nào sau đây không tạo chất khí sau phản ứng?
(A) Nung AgNO3 rắn. (B) Đun nóng C với H2SO4 đặc. (C) Cho dung dịch KHSO4 vào dung dịch NaHCO3.
(D) Hoà tan NaHCO3 trong dung dịch NaOH. Câu 24. Nhận xét nào sau đây sai ?
- Phenyl fomat phản ứng với dung dịch NaOH dư tạo hỗn hợp hai muối. B. Anilin tan trong dung dịch NaOH. C. Metylamin không phản ứng với dung dịch FeCl3. ..
- Isopropylamin là amin bậc một. Câu 25. Từ hai muối X và Y thực hiện các phản ứng sau: (1)X = X,+ CO2
(2) X, +4,0-X, (3) X, +Y →X+Y, +H20 (4) X, +2Y+X+YA+2H,0 Hai muối X, Y tương ứng là A. CaCO3, NaHSO4
- BaCO3, Na2CO3. C. CaCO3, NaHCO3.
- MgCO3, NaHCO3. Câu 26. Đốt cháy hoàn toàn 7,6 gam hỗn hợp X gồm metylamin và etylamin, thu được
sản phẩm có chứa 2,24 lít khí H2 (đktc). Cho 7,6 gam X tác dụng với dung dịch HCl dư, thu được m gam muối. Giá trị của m là A. 11,25.
- 11,15. C. 14,90. D. 14,70. Câu 27. Cho dãy các chất :NaHCO3, CO, Al(OH)3, Fe(OH)3, HF, SiO2, Cr2O3, Cl2, NH4Cl.
Số chất trong dãy tác dụng được với dung dịch NaOH loãng, ở nhiệt độ thường là A. 4.
- 7. C. 5.
- 6. Câu 28. Cho sơ đồ chuyển hoá sau:
C3H4O2 + NaOH+X+Y và X+ H2SO4 loãng+Z+T. . Biết Y và Z đều có phản ứng tráng bạc. Y và Z lần lượt là A. HCHO, CH3CHO. .. . . B. HCHO, HCOOH.. .! C. HCOONa, CH3CHO.
- CH3CHO, HCOOH Câu 29. Bốn kim loại Na, Al, Fe và Cu được ấn định không theo thứ tự X, Y, Z, T biết
rằng: – – X và Y được điều chế bằng phương pháp điện phân nóng chảy. -X đẩy được kim loại T ra khỏi dung dịch muối.
– – Z tác dụng được với dung dịch H2SO4 đặc, nóng nhưng không tác dụng được với
dung dịch H2SO4 đặc, nguội. X, Y, Z, T theo thứ tự là A. AI, Na, Cu, Fe.
- Na, Al, Fe, Cu. C. Na, Fe, Al, Cu.
- Al, Na, Fe, Cu. Câu 30. Hỗn hợp M gồm hai ancol no, đơn chức, mạch hở X, Y và một hiđrocacbon Z.
Đốt cháy hoàn toàn M cần dùng 0,07 mol O2 và thu được 0,04 mol CO2. Công thức phân tử của X là A. C3H6 B. C2H4.
- CH4. D. C2H6. Câu 31. Cho các thí nghiệm sau:
(a) Cho dung dịch Fe(NO3)3 vào dung dịch AgNO3. (b) Cho dung dịch FeCl2 vào dung dịch AgNO3. (c) Cho dung dịch Fe(NO3)2 vào dung dịch HCl. (d) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3. (e) Cho KOH vào dung dịch K2Cr2O7. (g) Cho Cr vào dung dịch NaOH. Trong các thí nghiệm trên, số thí nghiệm xảy ra phản ứng hoá học là A. 6.
B.3. C. 4.
- 5. Câu 32. Hiđro hoá hoàn toàn chất hữu cơ X thu được ancol Y. Đốt cháy hoàn toàn Y thu
được CO2 và H2O theo tỉ lệ mol là 2:3. Số chất X thoả mãn là A. 1.
- 4. C. 2.
- 3.
. Câu 33. Nhỏ từ từ 3V ml dung dịch Ba(OH)2 (dung dịch X vào V ml dung dịch Al2(SO4)3
(dung dịch Y) thì phản ứng vừa đủ thu được kết tủa lớn nhất có khối lượng m gam. Nếu trộn V ml dung dịch X vào V ml dung dịch Y, thu được m gam kết tủa. Tỉ lệ m/my là
- 1,37. FE B . 2,20. C. 3,00. D. 1,65. Câu 34. Thí nghiệm điều chế và thử tính nhẹ của Hạ được mô tả như hình vẽ dưới đây.
Nhận xét nào sau đây sai ? A. Thay HSO4 loãng bằng H2SO4 đặc thì bọt khí .
Bóng xà phòng bay lên nhanh hơn. B. Thay kẽm hạt bằng kẽm bột thì bọt khí bay lên nhanh hơn. C. Thay bột Zn bằng bột Fe có cùng kích thước hạt HFSO thì khí bay lên chậm hơn.
Nuớc
xà phòng — D. Thêm vài giọt CuSO4 vào ống nghiệm thì bọt khí. bay lên nhanh hơn.
Câu 35. Cho X, Y, Z, T là các chất khác nhau trong số 4 chất : glixerol, glucozơ, axit
axetic, axit fomic. Bảng dưới đây ghi lại các hiện tượng khi làm thí nghiệm với các chất sau ở dạng dung dịch nước :
– Chất | Thuốc thử NaHCO3
Sủi bọt khí | Không phản ứng | Không phản ứng | Sủi bọt khí Cu(OH)2
| Hoà tan
Hoà tan | Hoà tan . Hoà tan AgNO3/NH3, to Không
Có Không
Có tráng bạc tráng bạc
tráng bạc tráng bạc
Phát biểu nào sau đây là đúng ? A. X có nhiệt độ sôi thấp hơn nhiệt độ sôi của T. B. Y tác dụng với H2 (Ni, t°) tạo sobitol. C. z là chất dinh dưỡng và được dùng làm thuốc tăng lực.
- Có thể điều chế T từ C2H5OH bằng phương pháp lên men giấm. Câu 36. Đốt a mol X là trieste của glixerol và các axit đơn chức, mạch hở thu được b mol CO2 và c mol H2O, biết b = c = 4a. Hiđro hoá m gam X cần 6,72 lít H2 (đktc) thu
9 gam Y. Nêu đun m gam X với dung dịch chứa 0,7 mol NaOH đến phản ứng xảy ra hoàn toàn, cô cạn dung dịch sau phản ứng khối lượng chất rắn khan thu được là
- 53,2 gam. B. 61,48 gam. C. 57,2 gam. D. 52,6 gam. Câu 37. Cho 14,16 gam hỗn hợp X gồm : Fe, FeO, Fe2O3. Chia X thành 3 phần bằng
nhau. Khử hoàn toàn phần (1) bằng khí H2 dư, thu được 3,92 gam Fe. Phần (2) cho tác dụng với dung dịch CuSO4 dư, thu được 4,96 gam chất rắn. Hoà tan hoàn toàn phần (3) bằng dung dịch HCl vừa đủ được dung dịch Y. Cho Y tác dụng với dung dịch AgNO3 dư, thu được m gam chất rắn. Giá trị của m là A. 22,96.
- 25,12. C. 26,20.
- 28,36. Câu 38. X và Y là 2 hợp chất hữu cơ mạch hở, hơn nhau một nguyên tử cacbon,
Mx> Mr. Đốt cháy hoàn toàn 0,34 mol hỗn hợp E gồm X và Y bằng O2 rồi cho toàn bộ sản phẩm thu được (chỉ gồm CO2 và H2O) hấp thụ hết vào một dung dịch chứa 0,3 mol Ba(OH)2 và 0,1 mol NaOH sau phản ứng thu được 39,4 gam kết tủa. Khi cho 0,34 mol hỗn hợp E vào một dung dịch chứa 0,5 mol KOH đến phản ứng hoàn toàn, thu được dung dịch không còn KOH. Phần trăm khối lượng của Y trong hỗn hợp E là A. 31,24.
38,16. C. 34,28. D. 36,51. Câu 39. Hỗn hợp X gồm FeO, Fe2O3, S, FeS2 và CuS (oxi chiếm 16% khối lượng). Cho | 10 gam X tác dụng vừa đủ với dung dịch chứa 0,325 mol H2SO4 (đặc, đun nóng), thu được dung dịch Y gồm Fe, Cu? và SO2 và khí SO2 thoát ra. Nhúng thanh Mg vào Y, sau khi các phản ứng xảy ra hoàn toàn lấy thanh Mg ra làm khô và cân thấy
khối lượng tăng 3 gam (giả sử toàn bộ kim loại sinh ra bám vào thanh Mg). Mặt khác, đốt cháy hoàn toàn 10 gam X cần V lít khí O2 (đktc). Giá trị của V là A. 1,680.
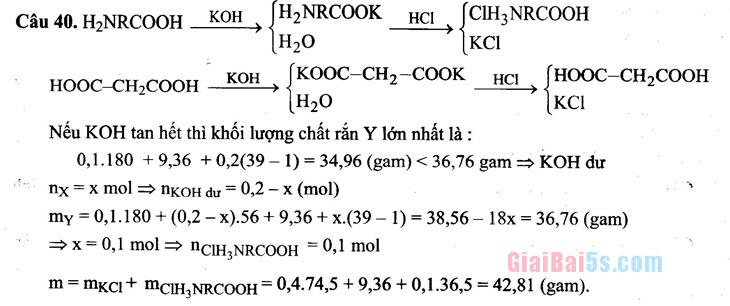
- 1,484. C. 0,924. D. 1,316. Câu 40. Cho 9,36 gam hỗn hợp X gồm 3 amino axit (phân tử chỉ chứa một nhóm
cacboxyl và một nhóm amino) vào dung dịch chứa 0,1 mol axit malonic, thu được dung dịch X. Thêm tiếp 400 ml dung dịch KOH 1M vào dung dịch X, sau khi các phản ứng xảy ra hoàn toàn, cô cạn dung dịch sau phản ứng thu được 36,76 gam chất rắn khan Y. Hoà tan Y trong dung dịch HCl (dư), thu được dung dịch chứa m gam muối. Giá trị của m là A. 13,01.
- 42,81. .. C. 39,16. . D. 46,46.
1 A 6 c 1 A 16 A 21 B 26 C 31 | 36 D
2 D 7 C 12 A 17 C 22 c 27 C 32 D 37 DI
3 C 8 D 13 D 18 B 23 D 28 D 33 C 38 D | 4 D 9 C 14 A 19 C 24 B 29 D 34 A 39 A
5 C 10 D 15 D 20 A 25 C 30 C 35 B 40 B Câu 30. Tách nước khỏi 2 ancol no, đơn chức mạch hở ta được hỗn hợp M gồm 2 anken
và Z.
Đốt cháy hoàn toàn Mỏ thì số mol O2 và CO2 không thay đổi so với đốt cháy M, số | mol H2O thu được sẽ là 0,06 (bảo toàn 0). Vậy nz=0,06 – 0,04 = 0,02 (mol).
Vì đốt cháy M thu được 0,04 mol CO2 nên Z chỉ có 1 nguyên tử C3Z là CH4. Câu 32. Từ tỉ lệ mol CO2 và H2O là 2:33nc: nH =2:6=Y là C2H6O và C2H4O2.
Nếu Y là C2H6O thì X là CH3CHO.
Nếu Y là C2H4O2 thì X là HO-HAC CHO và OHC-CHO. , , , , Câu 33. CM(Ba(OH) = a mol/l ; CM(A1,(SO4)= b mol/l = 1Ba2+ = 3V.a mol ; non-= 6V.a mol ; n 413+ = 2V.b mol ; nso?- = 3V.b mol
Ba2+ + S0 + Basoat A13+ + 30H + Al(OH)3+ (mol) 3V.a 3V.b
2V.b 6V.a > Kết tủa lớn nhất khi a=b.
Thêm V ml dung dịch Ba(OH)2 vào V ml dung dịch Al2(SO4)3 : n. 2+ = V.a mol; nou-= 2V.a mol; n 13+ = 2V.a mol; nc2- = 3V.a mol
AVROVIGORRIAGA
Zum
= M’Basoa = Ba2+ = V.a mol ; PALCOH), nor = V.a (mol) Ti le m – 233.3+2.78 = 3
* m2
233.1+78.
NON PEREN
Câu 37, nFe = a mol; nFeO = b mol ; nFe,O, = c mol Phần 1: Fe trong hỗn hợp X là a mol
FeO + H2 → Fe + H2O (mol) b
b Fe2O3 + 3H2 → 2Fe + 3H20 . (mol) C – 2c
nFe = a + b +2c=;
* 20 – 3,92
= 0,07 (mol)
(2)
3
0,02
Phần 2: Fe + Cu2+ + Fe2+ + Cu FeO, Fe2O + FeO, Fe2O3 7 (mol) a
– a – b c b c chất rắn = 64a + 72b + 160c = 4,96 gam
(2) Khối lượng mỗi phần m = ‘,’° = 4,72 = 56a + 72b + 160c Từ (1), (2), (3)= a = 0,03 ; b = 0,02 ; c = 0,01. Phần 3: Fe + 2HCl → FeCl2 + H21 FeO + 2HCl → FeCl2 + H20 (mol) 0,03
0,03
0,02 Fe2O3 + 6HCl → 2FeCl3 + 3H20 (mol) 0,01
0,02 ng- = 0,03.2 +0,02.2 +0,02.3 = 0,16 (mol) n. 2+ = 0,03 + 0,02 = 0,05 (mol) CE + Ag → AgCi
Fe2+ + Agt → Ag + Fe3+ (mol) 0,16 0,16
0,05
0,05 >m=0,16.143,5+0,05.108 = 28,36 (gam). Câu 38. Vì số mol BaCO3 = 0,2 < 0,348OH hết.
ncoz- = non–nco, >nco, = 0,7 – 0,2 = 0,5 (mol) | Cb = 0,5 – 0,34 = 1,47 31 chất có 1C, 1 chất có 2C. Khi cho 0,34 mol hỗn hợp E vào một dung dịch chứa 0,35 mol KOH đến phản ứng hoàn toàn, thu được dung dịch không còn KOH = E gồm HCOOH và (COOH)2. x+y=0,34 x=0,18
► %HCOOH = 36,51%. (x + 2y = 0,5 ly=0,16 Câu 39. mo= 1,6 gam – no= 0,1 mol
Giả sử hỗn hợp X được tạo thành từ hỗn hợp X gồm Fe (a mol) ; Cu (b mol) ; S (x mol) và 0 (0,1 mol). x + x +0,325 mol H2SO4 +Dung dịch Y (a mol Fe; b mol Cu2+; y mol SO2 ) + SO2 (z mol) + H20 (0,325 mol). Ta có : Tổng khối lượng : 56a + 64b + 32x + 1,6 = 10
Bảo toàn NT 0:0,1 + 4.0,325 =4y + 2z + 0,325 + 4y + 2z= 1,075 Bảo toàn NT S: x + 0,325 =y+z. Bảo toàn điện tích : 3a + 2b = 2y . Khối lượng thanh kim loại tăng : 56a + 64b – 24.”
” 2 Giải hệ (1), (2), (3), (4), (5) = a= 0,1 ; b= 0,025 ; x = 0,0375 ;y=0,175 ;z=0,1875. Đốt cháy X, thu được : Fe2O3 (0,5a mol) ; CuO (b mol), SO2 (x mol).
1,5a + b + 2x -0,1 i no, =
^ = 0,075 (mol)= Vo, = 1,680 lít.
(3)
3a + 2b =3.
(5)
UNRCOOK H
KCI
KCI
Câu 40. H.NRCOOH KOH SH2NRCOOK HCI SCIH3 NRCOOH
H20 HOOC-CH2COOH – Ý nouKOH SKOOC-CH2-COOK HCI SHOOC-CH2COOH
H20 Nếu KOH tan hết thì khối lượng chất rắn Y lớn nhất là :
| 0,1.180 +9,36 + 0,2(39 – 1)= 34,96 (gam) < 36,76 gam = KOH dư – nx =x mol = n(OH dư = 0,2 – x (mol) my = 0,1.180 + (0,2-x).56 +9,36 +x.(39 – 1) = 38,56 – 18x = 36,76 (gam)
x= 0,1 mol = NCIHNRCOOH = 0,1 mol m=mkcı + MCIH,NRCOOH = 0,4.74,5+9,36 +0,1.36,5 = 42,81 (gam).
