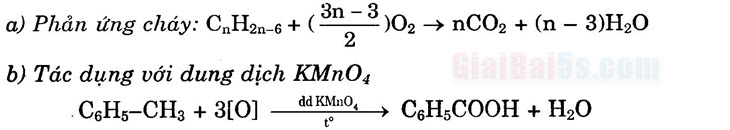| A. KIẾN THỨC CẦN NHỚ
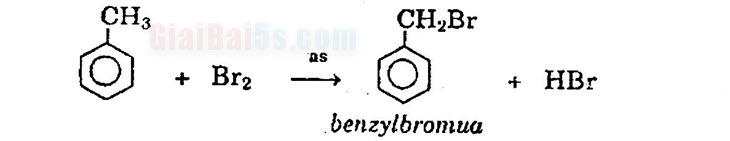
Tính chất hóa học 1) Phản ứng thế a) Tác dụng với brom:
– Do ảnh hưởng của nhân thơm đối với mạch nhánh, nên khi chiếu sáng, toluen tham gia phản ứng thế nguyên tử hiđro ở nhóm CH3 dễ dàng hơn CH4.
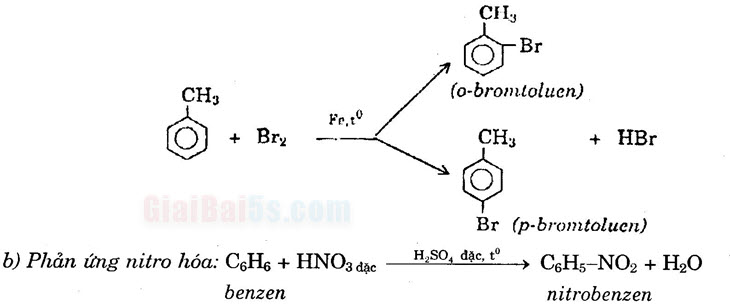
– Toluen tham gia phản ứng brom ở vòng dễ dàng hơn và tạo thành hỗn hợp hai đồng phân.
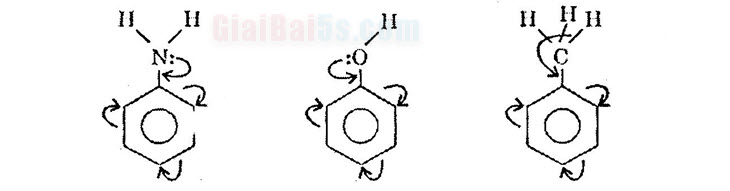
Quy luật thế ở vòng benzen a) Nếu trong vòng benzen đã có sẵn một nhóm thể loại I (các nhóm ankyl, JOH, F, Cl, Br, I…) thì nhóm này sẽ định hướng cho nhóm thế mới vào vị trí ortho và para.
b) Nếu trong vòng benzen đã có sẵn nhóm thể loại II (các nhóm NO2, COOH, CHO,…) thì nhóm này sẽ định hướng cho nhóm thế mới vào vị trí meta. 2) Cộng clo:
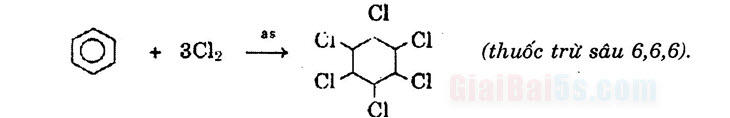
3) Phản ứng oxi hóa
|


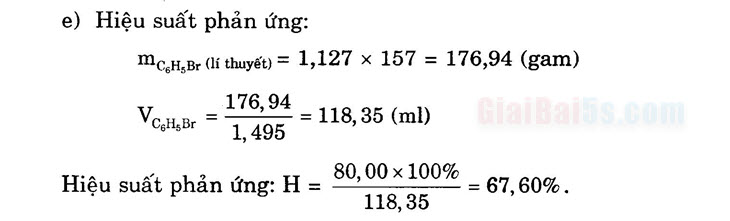
Nguồn website giaibai5s.com
- HƯỚNG DẪN GIẢI VÀ ĐÁP ÁN BÀI TẬP SGK TRANG 191 – 192 Câu 1. Câu đúng: b, d, e,
Câu sai: a, c, g.
TT n112n-6
ddk
Câu 2.
Sở dĩ người ta biểu diễn công thức cấu tạo của benzen bằng một hình lục giác đều với 1 vòng tròn ở trong vì:
– 6 nguyên tử C và 6 nguyên tử H trong phân tử benzen đều nằm trên 1 mặt phẳng.Các góc hóa trị đều bằng 120°C.
– Các liên kết C-C có độ dài bằng nhau.
– 6 obitan p xen phủ bên tạo một obitan 1 chung cho cả phân tử. Câu 3.
Chất có thể chứa vòng benzen: a) CgHaCl2; d) C16H2(NO2)2 (độ chất bão hòa ở benzen là 4). Chất không thể chứa benzen: b) C10H6 độ bất bão hòa = 3 x 4 (độ bất bão hòa ở benzen là 4)
- c) CH-BrCl: độ bất bão hòa = 2 < 4.
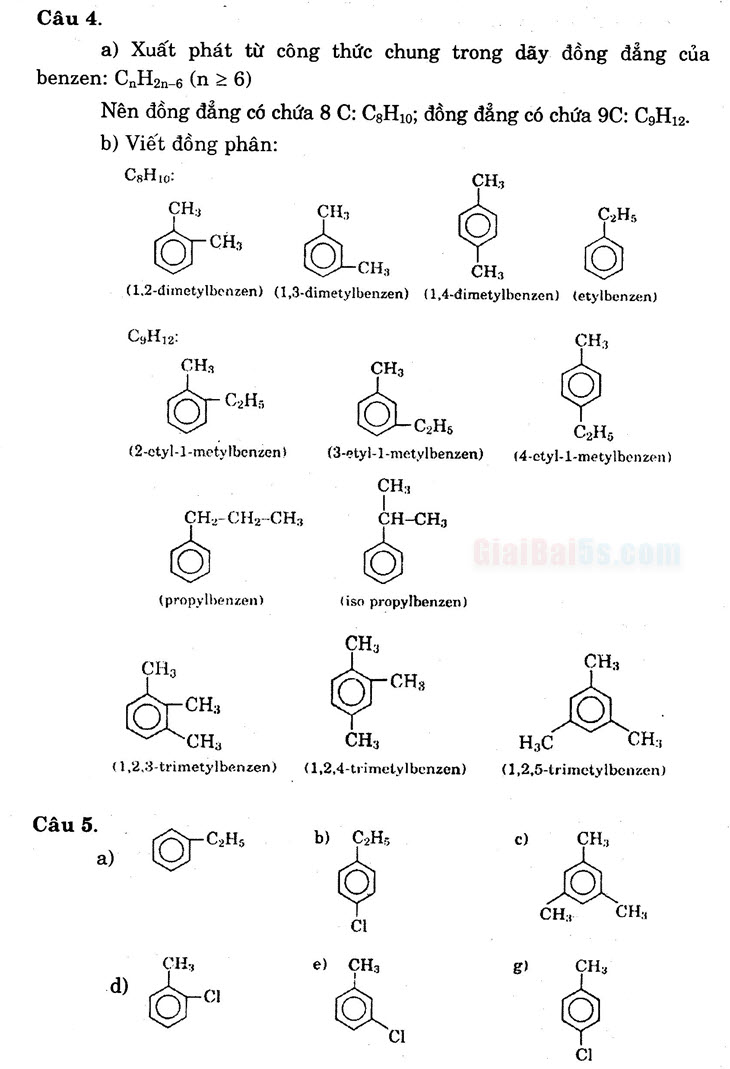
Câu 4.
- a) Xuất phát từ công thức chung trong dãy đồng đẳng của benzen: CnH2n-6 (n = 6)
Nên đồng đẳng có chứa 8 C: CgHo; đồng đẳng có chứa 9C: C,H,.. | b) Viết đồng phân:
CH10
CH; O CH;
CH3 (1.2-dimetylbenzen) (1,3-dimetylbenzen) (1,4-dimetylbenzen) (etylbenzen)
OCH
.
CH3
C3H12:
CH,
CH;
OCH
..
C2H1.. (4-etyl-1-metylbenzen)
.
(2-etyl-1-metylbenzen)
C2H (3-etyl-1-metylbenzen)
CH; : CH-CH,
::.
.
CH.,-CH2-CH3
(propylbenzen)
(iso propylbenzen)
–
CH:
OH
:
OTCH
YCH:
CH
CH (1,2,4-trimetylbenzen)
HC
CH; (1,2,5-trimetylbenzen)
(1,2,3-trimetylbenzen)
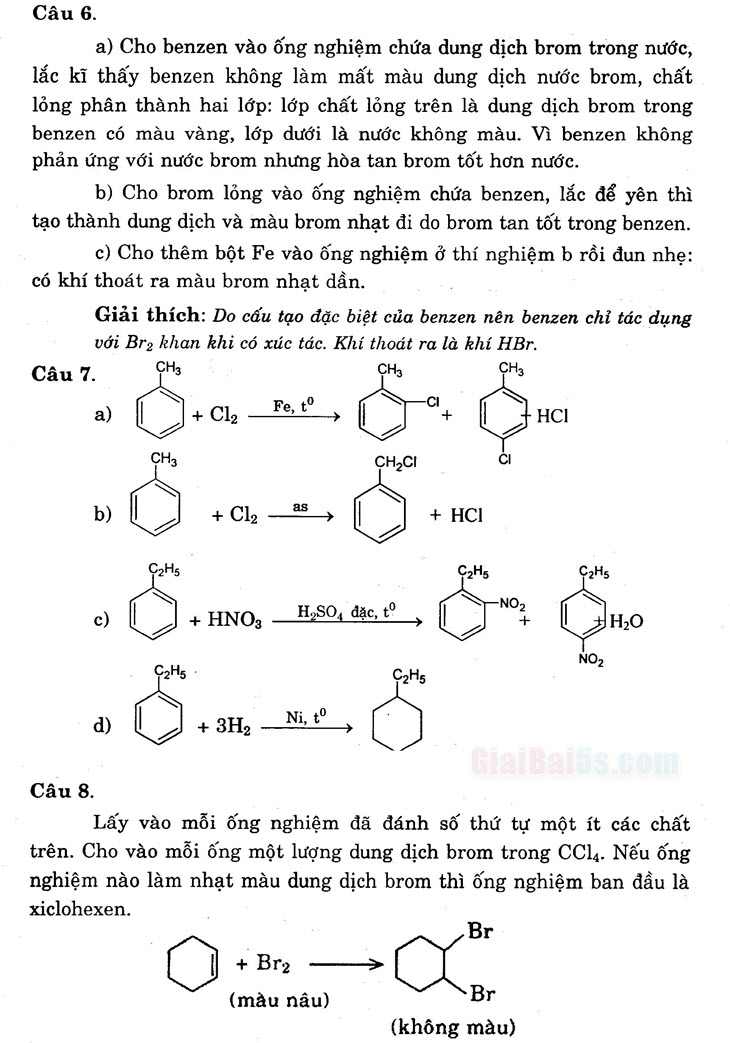
Câu 5.
6C2H
b)
C2H5
C). ÇH;
CH.
CH,
…
- e) <H
Câu 6.
- a) Cho benzen vào ống nghiệm chứa dung dịch brom trong nước, lắc kĩ thấy benzen không làm mất màu dung dịch nước brom, chất lỏng phân thành hai lớp: lớp chất lỏng trên là dung dịch brom trong benzen có màu vàng, lớp dưới là nước không màu. Vì benzen không phản ứng với nước brom nhưng hòa tan brom tốt hơn nước.
- b) Cho brom lỏng vào ống nghiệm chứa benzen, lắc để yên thì tạo thành dung dịch và màu brom nhạt đi do brom tan tốt trong benzen.
- c) Cho thêm bột Fe vào ống nghiệm ở thí nghiệm b rồi đun nhẹ: có khí thoát ra màu brom nhạt dần.
Giải thích: Do cấu tạo đặc biệt của benzen nên benzen chỉ tác dụng
0ới Br2 khan khi có xúc tác. Khí thoát ra là khí HBr. Câu 7. CH3 .
CH3 Fe, to
“+
CH3
.
CH,
as
Cl, –
+ HCl
14 HNO,
H2SO4 đặc, t_
.
:
C2H5 .
.
.
C
…
5
Ni, to
.
.
Câu 8.
Lấy vào mỗi ống nghiệm đã đánh số thứ tự một ít các chất trên. Cho vào mỗi ống một lượng dung dịch brom trong CCl4. Nếu ống nghiệm nào làm nhạt màu dung dịch brom thì ống nghiệm ban đầu là xiclohexen.
Br . o + Br2 —> (màu nâu)
(không màu)
Tiếp tục cho vào ống nghiệm còn lại một lượng brom, thêm chút | bột Fe xúc tác. Đun nóng cả hai ống nghiệm. Đưa vào miệng hai ống nghiệm một mẫu giấy quỳ tím ẩm. Quan sát thấy ống nghiệm nào giấy quỳ tím hóa đỏ thì ống ban đầu đó là ống nghiệm đựng benzen.
O + Brybột Fe, t”, Or Br + HBr
| Còn lại là xiclohexan. Câu 9.
Vì C8H10 không làm mất màu dung dịch brom » CgHo là hợp chất thơm, vì nếu là hợp chất không no thì làm mất màu dung dịch brom. Khi hiđro hóa mạch C không bị biến đổi, vì vậy từ công thức cấu tạo của 1,4-đimetyl xiclohexan suy ra công thức cấu tạo của CgHo và viết phương trình phản ứng như sau:
CH3 –
CH2 + 3H, bót ke, “> CH3
CH3
Ta có: nc,H.
78
ùng
1,4-dimetylbenzen,
-p-dimetylbenzen, p-xilen Câu 10.
- a) Tương tự hình 7.3 và 8.1 (thay thế HNO3, H2SO, bằng brom lỏng) b) Phản ứng: C6H6 + Br2 Fe + C6HBr + HBr (1)
100 x 0,879 ,
19 = 1,127 (mol) Từ (1)= nee, bản dùng = 1,127 (mol) Vậy Va, cản đang =
1,127 x 160
= 58,168 (ml)
3,1 c) Từ (1) = nHBr sinh ra = 1,127 (mol)
| HBr + NaOH + NaBr + H2O (2) (mol) 1,127 1,127 Từ (2) = nNaOH = 1,127 (mol) m OH = 1,127 x 40 = 45,08 (gam). d) Hỗn hợp sau phản ứng: C6HBr, HBr, C6H6 (dư), Br2 (dư). Rửa hỗn hợp bằng dung dịch kiềm:
HBr + NaOH 2NaBr + H2O
Br2 + 2NaOH → NaBr + NaBrO + H2O Chiết lấy hỗn hợp C6H5Br và C3H6Chưng cất hỗn hợp, loại bỏ benzen có t°gôi – 80°c còn lại là
brom benzen có tosôi ~ 156°C.
- e) Hiệu suất phản ứng:
mc H.BA (lí thuyết) = 1,127 x 157 = 176,94 (gam)
176,94
VCH5Br = 1,495
= 118, 35 (ml)
Hiệu suất phản ứng: H =
80,00 x 100%
O = 67, 60%. 118,35
–