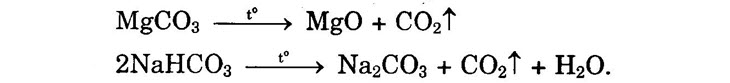| A. KIẾN THỨC CẦN NHỚ
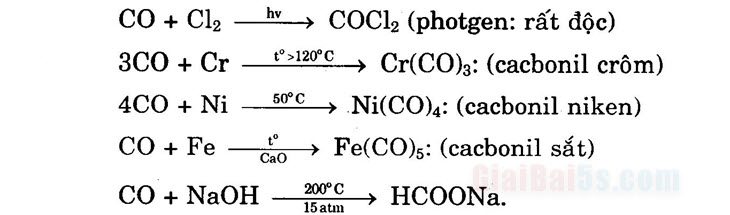
I. Tính chất hóa học của cacbon monooxit (CO) +) CO gọi là oxit không tạo muối (hay oxit trơ) +) Tác dụng với oxi (chất khử mạnh). 2CO + O2 → 2CO2 (cháy với ngọn lửa màu xanh nhạt và tỏa nhiệt). +) Khử được oxit kim loại (sau Al2O3):
+) Phản ứng định lượng CO: 5CO + I2O5 → I2 + 5CO2↑ +) Phản ứng định tính CO: CO + H2O + PbCl2 → Pb↓ + 2HCl + CO2↑ +) Tham gia phản ứng kết hợp:
+) Tan trong nước tạo thành dung dịch axit cacbonic:
+) Tác dụng với kim loại hoạt động mạnh ở nhiệt độ cao:
Chú ý: Không dùng khí CO2 để dập tắt đám cháy của các kim loại hoạt động mạnh. +) CO2 là oxit axit nên tác dụng được với bazơ và oxit bazơ: CO2 + BaO → BaCO3 CO2 + 2NaOH → Na2CO3 + H2O CO2 + CaCO3 + H2O → Ca(HCO3)2 +) Khí CO2 khô kết hợp với amoniac lỏng tạo thành urea: CO2 + 2NH3 → (NH2)2CO +H2O III. Muối cacbonat +) Tác dụng với axit: NaHCO3 + HCl → NaCl + CO2↑ + H2O Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O +) Tác dụng với dung dịch kiềm: Ca(HCO3)2 + Ca(OH)2 + 2CaCO3↓ + 2H2O Ca(HCO3)2 + 2NaOH → CaCO3↓ + Na2CO3 + H2O +) Phản ứng nhiệt phân:
|
B. HƯỚNG DẪN GIẢI VÀ ĐÁP ÁN BÀI TẬP SGK TRANG 87 – 88


Nguồn website giaibai5s.com
Câu 1. ZnO + C + Zn + CO Câu 2.
- a) Phương pháp vật lí: nén dưới áp suất cao, CO, hóa lỏng tách ra khỏi CO. | b) Phương pháp hóa học
Hấp thụ CO2 vào dung dịch Ca(OH)2 dư. Lọc lấy kết tủa rồi cho tác dụng với axit HCl.
Khí CO không bị hấp thụ nên tách ra. Câu 3.
ạ) Cho hỗn hợp qua dung dịch H2SO4 đặc, sau đó cho qua dung dịch Ca(OH)2 | b) Dùng các phản ứng:
NaHCO3 = ,2990 – Na Coz
Ca(HCO3)2 =200,,0 CaCO3 Câu 4.
Dẫn hỗn hợp khí lội qua dung dịch brom, nếu thấy nước brom bị nhạt màu nhận được SO2
SO2 + Br2 + 2H2O → 2HBr + H2SO4 Tiếp tục dẫn hỗn hợp khí lội qua dung dịch nước vôi trong, thấy nước vôi trong vẩn đục nhận được CO2
CO2 + Ca(OH)2 → CaCO3k + H2O. Câu 5. Đáp án: B.
A là K2CO3: dung dịch làm quỳ tím ngả màu xanh. B là Ba(NO3)2 dung dịch không làm thay đổi màu quỳ tím.
K2CO3 + Ba(NO3)2 → BaCO3+ + 2KNO3 Câu 6. Phản ứng: CO2 + Ca(OH)2 → CaCO3+ + HẠO (1) CO + CuO → Cu + CO2
(2) Từ (1) = neo, =nCaCO, = a = 0,1 (mol)
10
00
Từ (2) => no = nu = 3 = 0,1 (mol)
10
10
Do đó: n h =
1 = 0,45 (mol) = Nuh =
22.4 –
i = 55,56%.
Vậy: %Vo = x 100% = 22,22% và % Vo, = 22,22%. Nếu phản ứng (2) thực hiện trước rồi mới đến phản ứng (1) thì:
= Enco, = n2o, +nco, = 0,1 +0,1 = 0,2 (mol) = nCaCO = 0,2 (mol). Vậy: maCO, = 0,2 x 100 = 20 (gam).

 II. Tính chất của cacbon đioxit và axit cacbonic
II. Tính chất của cacbon đioxit và axit cacbonic