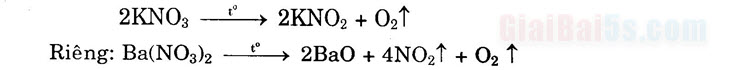| A. KIẾN THỨC CẦN NHỚ
I. AXIT NITRIC (HNO3) 1. Tính axit a) Dung dịch HNO3 làm quỳ tím hóa đỏ. b) Tác dụng với oxit bazơ: CuO + 2HNO3 → Cu(NO3)2 + H2O c) Tác dụng với bazơ: Ca(OH)2 + 2HNO3 + Ca(NO3)2 + 2H2O d) Tác dụng với muối của axit yếu: CaCO3 + 2HNO3 → Ca(NO3)2 + CO2↑ + H20 2. Tính oxi hóa a) Với kim loại: – Khi tác dụng với những kim loại có tính khử yếu như Cu, Ag, …, HNO3 đặc bị khử đến NO, còn HNO3 loãng bị khử đến NO: Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2↑ + 2H20 3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO↑ + 4H20 – Khi tác dụng với những kim loại có tính khử mạnh hơn như Mg, Zn, Al …, HNO3 loãng bị khử đến N2O hoặc Nu và HNO3 rất loãng bị khử đến NH3 (ở dạng NH4NO3). 8Al + 30HNO3 loãng → 8AI(NO3)3 + 3N20↑ + 15H20. 5Mg + 12HNO3 loãng → 5Mg(NO3)2 + N2↑ + 6H20. 4Zn + 10HNO3 loãng→ 4Zn(NO3)2 + NH4NO3 + 3H20. b) Với phi kim: Axit nitric đặc có thể tác dụng được với các phi kim như C, N, P, … Khi đó, các phi kim loại bị oxi hóa đến mức oxi hóa cao nhất, còn HNO3 bị khử đến NO, hoặc NO tùy theo nồng độ của axit. C + 4HNO3 đặc → CO2↑+ 4NO2↑ + 2H2O 3P + 5HNO3 loãng → 2H2O + 3H3PO4 + 5NO↑ S + 6HNO3 đặc → H2SO4 + 6NO↑+ 2H2O 3I2 + 10HNO3 → 6HIO3 + 10NO↑+ 2H2O c) Với hợp chất: Các hợp chất như H2S, HI, SO3, FeO, muối sắt (II), … tác dụng được với dung dịch HNO3.
II. MUỐI NITRAT 1) Sự thủy phân Muối nitrat của kim loại kiềm, kiềm thổ thì không bị thủy phân, còn muối của các kim loại khác bị thủy phân tạo môi trường axit.
a) Với dung dịch muối khác: Pb(NO3)2 + K2SO4 → PbSO4↓ + 2KNO3 b) Với dung dịch axit: Ba(NO3)2 + H2SO4 → BaSO4↓ + 2HNO3 c) Với dung dịch kiềm: Fe(NO3)3 + 3KOH → Fe(OH)3↓ + 3KNO3 3) Bị nhiệt phân hủy a) Nhiệt phân muối nitrat của kim loại trước Mg: Tạo thành muối nitrợ và khí O2
b) Nhiệt phân muối nitrat của kim loại từ Mg + Cu: Tạo thành kim loại + NO2 + O2
c) Nhiệt phân muối nitrat của kim loại sau Cu: Tạo thành kim loại + NO2 + O2
|
B. HƯỚNG DẪN GIẢI VÀ ĐÁP ÁN BÀI TẬP SGK TRANG 55



Nguồn website giaibai5s.com
Câu 1.
Công thức electron và công thức cấu tạo của axit nitric: Công thức: H::N: 0:
: : 0 :
O
=
Công thức cấu tạo: HÔo – N..
– Trong phân tử axit HNO3: nitơ có số oxi hóa + 5. Câu 2.
- a) Fe + 6HNO3 (dác, nóng) → Fe(NO3)3 + 3N02 + 3H20 b) Fe + 4HNO3 (loảng) → Fe(NO3)3 + NO + 2H20 c) Ag + 2HNO3 (đặc) + AgNO3 + NO2 + H2O
- d) P + 5HNO3 (đặc) + H3PO4 + 5NO2 + H2O. Câu 3. Phương trình phản ứng thực hiện sơ đồ chuyển hóa:
N2 + 02 _3000°C_2NO 2NO + O2 + 2NO2 2NO2 + O2 + H2O + 2HNO3 2HNO3 + Ca(OH)2 + Ca(NO3)2 + 2H,0
N2 + 3H2 – to, xt _2NH2
2NH3 +502 +850°C__ 2N0 + 3H20 2NO + 02 → 2N02 2N02 + O2 + H20 → 2HNO3
HNO3 + NH3 → NH4NO3 Câu 4. Đáp án D. Câu 5.
Khi điều chế HNO3 bốc khói (HNO3 tinh khiết) phải sử dụng H2SO4 đặc và NaNO3 rắn vì dung dịch tạo ra (HNO3 69%) tạo nên hỗn hợp đồng sôi. Nếu dùng H2SO4 loãng và dung dịch NaNO3 khi chưng cất chỉ thu được HNO3 loãng hơn (vì HNO3 tan trong nước bất kỳ tỉ lệ nào). Câu 5. Đáp án A. Câu 6.
Al + 4HNO3 → Al(NO3)+ NO + 2H,0 (mol) x 4x
8A1 + 30HNO3 + Al(NO3)2 + 3N2O + 15H20 (modd y Boy Theo đề bài, ta có hệ phương trình: x + y = 0,5 =
(a)
3y
13,5
27
30x + 44.
_ 19,2×2
.
x +
y
MID
Từ (b) = 4x = y, thế vào (a)=x = 0,1 (mol); y = 0,4 (mol) Từ (1) và (2) = 2nNo, = 4x + 3y = 0,4 + 1,5 = 1,9 (mol)
Vậy: CMHNO, = 3 = 0,863 (mol) Câu 7. a) Phương trình phản ứng:
4MS + 702 + 2M203 + 4502 M2O3 + 6HNO3 → 2M(NO3)3 + 3H30
(1)
32
–
Từ (1) và (2): nHNO, = 3nMs . M(NO3)2 = nms =MM(NOx) = nms (M +186) (*)
63 x 100 x 3 x nus Theo đó: mdd(HNO, 37,8%) =
– = 500nms
97 9 madmuối thu được)= 500 nMg + + nos(2M + 48) = nMs (524 + M) Khối lượng muối M(NO3)3 thu được là:
nus x (524 + M) x 41,7 – M +186)
. 100
> M = 56 = Fe = muối: FeS. b) Ta có: nres = = 0,05 (mol).
88 | Từ (1) và (2): nHNO, = 3nres = 0,15 (mol).
0,15 x 63 x 100 m(HNO437,8%) =
– = 25 (gam). . . 37,8

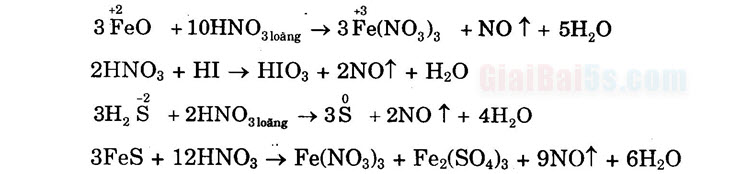
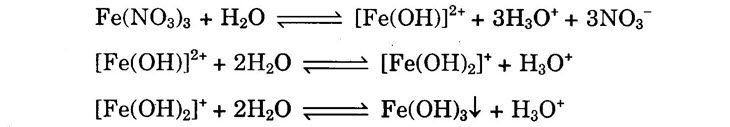 2) Phản ứng trao đổi
2) Phản ứng trao đổi