| A. KIẾN THỨC CẦN NHỚ
I. AMONIAC (NH3) 1. Tính bazơ yếu a) Tác dụng với nước:
b) Tác dụng với axit: 2NH3 + H2SO4 → (NH4)2SO4 NH3 + H+ → NH4+. NH3(k) + HCl(k) + NH4Cl(r): dùng để nhận ra khí amoniac. c) Dung dịch amoniac có thể làm kết tủa nhiều hiđroxit kim loại: Al3+ + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4+. Fe2+ + 2NH3 + 2H20 → Fe(OH)2↓ + 2NH4+. 2. Khả năng tạo phức: Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại, tạo thành các dung dịch phức chất. Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2. Cu(OH)2 + 4NH3 + [Cu(NH3)4]2+ + 2OH‾ (màu xanh thẫm) Chú ý: Phản ứng với NH3 giúp ta phân biệt Al với Zn (cả hai đều tan trong NaOH) nhưng chỉ có Zn(OH)2 tan trong NH3. 3. Tính khử: a) Tác dụng với oxi:
Nếu có xúc tác là hợp kim platin và iriđi ở 850 – 900°C thì:
b) Tác dụng với clo:
8NH3 + 3Cl2 → N2↑ + 6NH4Cl. c) Tác dụng với một số oxit kim loại:
Phản ứng xảy ra tương tự chì oxit và sắt oxit. II. MUỐI AMONI 1. Phản ứng trao đổi ion 2. Phản ứng nhiệt phân a) Muối amoni tạo bởi axit không có tính oxi hóa khi đun nóng bị phân hủy thành amoniac và axit.
|
B. HƯỚNG DẪN GIẢI VÀ ĐÁP ÁN BÀI TẬP SGK TRANG 47 – 48



Nguồn website giaibai5s.com
Câu 1.
Mô tả và giải thích hiện tượng NH3 tan nhiều trong nước: cho khí NH3 vào đây bình, một đầu bình có gắn ống dẫn khí bằng thủy tinh, úp ngược bình chứa đầy khí vào chậu nước có pha vài giọt phenolphtalein, ta thấy sau ít giây nước phun vào choán phần chân không của bình tạo thành dung dịch có màu đỏ tím. Hiện tượng tan nhiều là do có sự tương tác giữa NH3 và nước, là những chất đều có phân tử phân cực mạnh. Câu 2.
| Nhận biết NH3 trong số các bình khí N2, Cl2, O2, CO,.
| Dùng giấy quỳ tím tẩm ướt đưa vào các bình khí, ở bình khí nào quỳ tím chuyển màu xanh đó là khí NH3.
Hoặc dùng que quấn bông tẩm axit HCl đặc đưa vào miệng các bình khí. Ở miệng bình nào xuất hiện khói màu trắng đó là bình khí NH3. Câu 3.
Tính chất hóa học đặc trưng của NH3. a) Tính bazơ yếu +) Tác dụng với nước: NH3 + H2O = NH+ + OH+) Tác dụng với axit:
NH3 + H2SO4 + NH4HSO4
NH3 + H+ + NH4+ +) Tạo kết tủa nhiều hiđroxit kim loại (Fe2+ , Fe3+, Al +, …) của các muối tương ứng:
3NH3 + 3H2O + FeCl3 + Fe(OH)3+ + 3NH4Cl
3NH3 + 3H20 + Fe3+ → Fe(OH)3 + 3NH4 +) Tạo phức: khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại như Cu, Zn, Ag…
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 b) Tính khử :
* , R hoặc Ý 2NH, , , + 3H,o
.
2ÑH,+ 40, ->Ň, + 34,0
2
Ứng dụng của NH3: dùng để sản xuất axit nitric, các loại phân đạm (NH4NO3, (NH4)2SO4, …) điều chế N H làm chất đốt tên lửa, chất gây lạnh cho máy lạnh
NH3 là là bazơ yếu vì khi hòa tan NHG kết hợp với ion H+ của nước tạo thành NH và ion OH-, mặt khác phản ứng xảy ra là phản ứng thuận nghịch:
NH3 + H20 = NH + OH| Nên so với dung dịch kiềm mạnh khi cùng nồng độ thì nồng độ ion OH cũng nhỏ hơn nhiều, vậy dung dịch NH là bazơ yếu. Câu 4. Đáp án: C. Câu 5. Khí A có thể là NH3 :
NH3 + H20 – NH+ OH NH3 + HCl → NH_C1 NH4Cl + NaOH → NaCl + NH3 + H2O NH3 + HNO3 → NH4NO3
NH4NO3 _t° ► NO2 + 2H,0 Câu 6. | Cân bằng: N2 (k) + 3H2 (k) + 2NH3 (k); AH = -92KJ.
- a) Khi tăng nhiệt độ cân bằng chuyển dịch theo chiều nghịch vì phản ứng nghịch là phản ứng thu nhiệt.
| b) Cân bằng chuyển dịch theo chiều thuận vì khi hóa lỏng NH3 và tách ra khỏi hỗn hợp làm giảm nồng độ NHg.
- c) Cân bằng chuyển dịch theo chiều thuận (chiều tạo NH3) vì khi giảm thể tích có nghĩa là tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm áp suất (có số mol phân tử ít hơn). Câu 7. Đáp án: B. Câu 8. Ta có: V, 841,7×21,03 = 177 (mo)
100
841,7 x 78,02 – 656,7 (mo) Vw=
100
–
Các phản ứng: CH4 + 2H2O + CO2 + 2 Ha
CH4 + 202 → CO2 + 2H20
N2 + 3H2 2NH3 Theo đề bài: –
VH, = 3VN, = 3 x 656,7 = 1970 (mo) Từ (2) = Yes, 3, 177 = 88,5 m.
V1,0 = Vox = 177 (m3) Từ (1) – VCH, Vu, = = 492,5 (mo) . .: V.V, = 1970 = 985 (mo) Vậy:VCH, = 492,5 + 88,5 = 581 (mo) và VH, = 985–177 = 808 (mo)

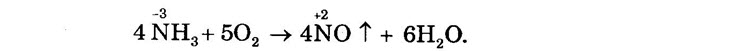
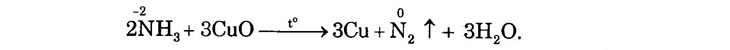
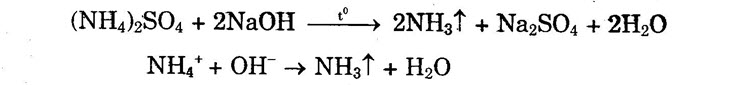
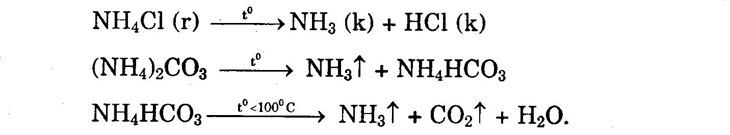 b) Muối amoni tạo bởi axit có tính oxi hóa như axit nitơ, axit nitric khi bị nhiệt phân cho ra Ng hoặc N2O (đinitơ oxit) và nước.
b) Muối amoni tạo bởi axit có tính oxi hóa như axit nitơ, axit nitric khi bị nhiệt phân cho ra Ng hoặc N2O (đinitơ oxit) và nước.