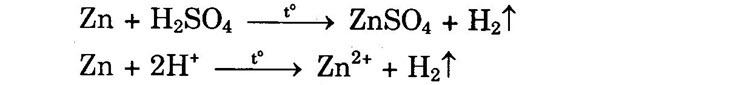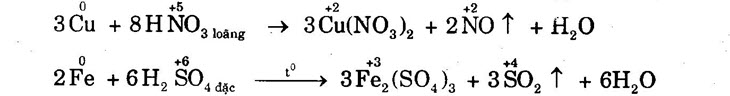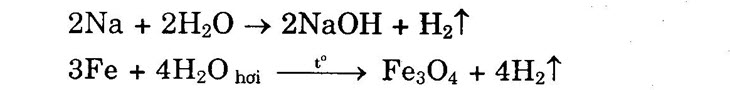| a. KIẾN THỨC CẦN NHỚ
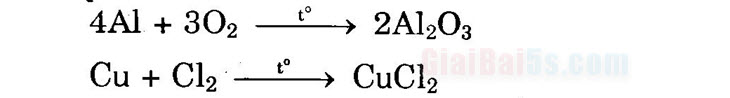
§1. KIM LOẠI I. Tính chất vật lí của kim loại 1. Tính chất chung: tính dẻo, tính dẫn điện, tính dẫn nhiệt, ánh kim. 2. Tính chất riêng: khối lượng riêng, nhiệt độ nóng chảy, tính cứng. II. Tính chất hóa học chung của kim loại Nguyên tử kim loại dễ bị oxi hóa thành ion dương: M → Mn+ + ne . 1. Tác dụng với phi kim
2. Tác dụng với axit a) Đối với dung dịch HCl, H2SO4 loãng:
b) Đối với HSo, (đặc, nóng), HNO3:
3. Tác dụng với dung dịch muối Fe + CuSO4 → FeSO4 + Cu↓ Chú ý: Kim loại đem tham gia phản ứng phải không tác dụng được với nước và đứng trước kim loại trong hợp chất muối trong dãy điện hóa. 4. Tác dụng với nước
$2. HỢP KIM I. Định nghĩa Hợp kim là vật liệu kim loại có chứa một kim loại cơ bản và một số kim loại hoặc phi kim khác. II. Tính chất của hợp kim Tính chất của hợp kim phụ thuộc vào thành phần các đơn chất tham gia cấu tạo mạng tinh thể của hợp kim. – Hợp kim không bị ăn mòn: Al-Mg, Cu-Zn, Fe Cr-Mn (thép inoc), – Hợp kim siêu cứng: W-Co, Co-Cr-W-Fe, … – Hợp kim có nhiệt độ nóng chảy thấp: Sn–Pb (210°C), Bi–Ph–Sn (65°C). – Hợp kim nhẹ, cứng và bền: Al-Si, A1-Cu-Mn-Mg. |



Nguồn website giaibai5s.com
- HƯỚNG DẪN GIẢI VÀ ĐÁP ÁN BÀI TẬP SGK TRANG 112 – 113 Câu 1. Chọn B Câu 2. Chọn C Câu 3. Chọn c . . Câu 4. Giải thích: . +) Tính dẻo: là do khi có tác dụng cơ học, các lớp mạng tinh thể
kim loại trượt lên nhau, nhưng không bị tách rời nhau nhờ lực hút tĩnh điện giữa các electron tự do với các cation kim loại trong mạng tinh thể. +) Tính dẫn điện, dẫn nhiệt: vì nó có tác dụng truyền dẫn nhiệt và điện giữa các electron trong kim loại. +) Ánh kim: do các electron tự do trong mạng tinh thể kim loại phản
xạ tốt những tia sáng có bước sóng mà mắt ta có thể nhìn thấy. Câu 5. +) Vị trí của kim loại trong bảng tuần hoàn: . .
– Các nguyên tố s (nhóm IA, IIA). – Các nguyên tố d (nhóm I-VIIIB).
Các nguyên tố f (họ lantan và họ actini). – Một phần các nguyên tố p. +) Vị trí kim loại có tính khử mạnh nhất: góc trái phía dưới bảng (nguyên tố Cs). +) Vị trí phi kim có tính oxi hóa mạnh nhất: góc phải phía trên bảng (nguyên tố F).
+) Cấu hình electron nguyên tử: Cs: [Xe]6s . F: 1s22s22p Câu 6.
+) Na: 1s22s22p@3s’ = Nat: 1s22s^2p +) Mg: 1s22s22p®3so3pR4s= Mg2+: 1s22s22p +) Ca: 1s22s22p®3s 3p®4s→ Cat: 1s22s22p%3s3p +) Fe: [Ar]3dR4s; Fe2+: [Ar]3d%; Fe$t: [Ar]3d
Câu 7. a) – Trường hợp xảy ra phản ứng:
| Fe + CuSO4 và Fe + Pb(NO3)2 – Vai trò các chất tham gia phản ứng:
- Chất khử: Fe.
- Chất oxi hóa: Cu2+, Pb2+ b) Phương trình phản ứng dạng ion thu gọn:
Fe + Cu2+ + Fe2+ + Cu
Fe + Pb2+ → Fe2+ + Pb Câu 8. a) Phản ứng: Cu + Fe2(SO4)2 → CuSO4 + 2FeSO4
Cu + 2Fe3+ → Cu2+ + 2Fe2+ Fe + CuSO4 → Cu + FeSO4
Fe + Cu2+ + Fe2+ + Cu b) So sánh: Fe có tính khử mạnh hơn Cu; Fe3+ có tính oxi hóa | mạnh hơn Cu?”Cuot có tính oxi hóa mạnh hơn Fe2t. Câu 9.
- a) Cho dung dịch hại muối tác dụng với bột Fe dư. Phản ứng xong, lọc bỏ bột Fe dư, nước lọc là dung dịch FeSO4. Phản ứng:
Fe + CuSO4 → FeSO4 + Cut
Fe + Cu2+ → Fe2+ + Cut b) Ngâm hỗn hợp bột Cu, Zn, Pb trong dung dịch Cu(NO3)2 dư. Phản ứng xong, lọc được chất rắn là Cu. Phản ứng:
Zn + Cu(NO3)2 → Zn(NO3)2 + Cut = Zn + Cu2+ → Zn2+ + Cut
Pb + Cu(NO3)2 + Pb(NO3)2 + Cut
Pb + Cu2+ + Pb2+ + Cut Câu 10. a) Phản ứng: Zn + CuSO4 + ZnSO4 + Cu
(1) Theo (1), cứ 1 mol Zn (65 gam) bị hòa tan thì sinh ra 1 mol Cu (64 gam) bám trên kim loại Zn. Do vậy khối lượng lá Zn giảm sau phản ứng. Tương tự, ta có: b) và c) khối lượng lá Zn tăng sau phản ứng.
- d) Khối lượng lá Zn giảm sau phản ứng.
Câu 11. Phương trình ion thu gọn:
M + Pb2+ → M2+ + Pb
M + Cu2+ → M2 + Cu | Gọi M g/mol là khối lượng mol của kim loại M. . n là số mol kim loại M tham gia phản ứng. và a là khối lượng lá kim loại M ban đầu. Theo (1): Khi có nM gam kim loại M tham gia phản ứng, sinh ra 207n gam Pb. Ta có phương trình: 207n-nu x 100% = 19%.
ra
=> a = “90
n(207 – M)
“? x 100 . .
19 Theo (2): Khi có nx gam kim loại M tham gia phản ứng, sinh ra 64n gam Cu. Ta có phương trình: nM – 64m x 100% = 96%.
.
a
n(M – 64)
>
a
x 100
(II)
9,6
.
.
Giải hệ phương trình (I, II) được M = 112 g/mol.
Kim loại M có khối lượng mol bằng 112 g/mol, là cađimi (Cd). Câu 12.
Giải tương tự bài 8. | Kim loại M có khối lượng mol bằng 65 g/mol là kẽm (Zn).